
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
【答案】33 2As2O3+5O2+6H2O=4H3AsO4+6S 加压反应速率增大,而且平衡右移,可提高生产效率 2△H1-3△H2-△H3 ac 大于 小于 tm时生成物AsO43-的浓度更小,故逆反应速率更慢 4y3/(x-y)2
【解析】
(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,原子结构示意图为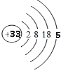 ,故答案为:
,故答案为: ;
;
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=
4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,故答案为:2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率;
(3)已知:①As(s)+ 3/2H2(g)+2O2(g)=H3AsO4(s)△H1②H2(g)+1/2O2(g)=H2O(l)△H2③2As(s)+5/2O2(g)=As2O5(s)△H3,则利用盖斯定律将①×2-②×3-③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=2△H1-3△H2-△H3,故答案为:2△H1-3△H2-△H3;
(4)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c.c(AsO43-)/c(AsO33-)不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c(AsO43-)=ymolL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2ymolL-1,所以c(I-)=ymolL-1时没有达到平衡状态,故d错误,故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正大于v逆,故答案为:大于;
③tm时比tn时浓度更小,则逆反应速率更小,故答案为:小于;tm时AsO43-浓度更小,反应速率更慢;
④反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L×20/(20+20+20)=xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43-)为ymol/L,则反应生产的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则K=y(2y)2/(x-y)(x-y)×12=4y3/(x-y)2,故答案为:4y3/(x-y)2。


科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,见光易分解,在潮湿空气中易被氧化,难溶于水。
(1)实验室保存新制CuCl晶体的方法是_________________。
(2)已知:Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
2CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则反应4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=____kJ/mol。
(3)利用CuCl难溶于水的性质,可以除去废水中的Cl-。向含Cl-的废水中同时加入Cu和CuSO4,溶液中平衡时相关离子浓度关系如图所示。[已知:pc(离子)=-lgc(离子)]

①除去废水中Cl-的离子方程式为_________________。
②Ksp(CuCl)=___________。
③已知:Cu+Cu2+![]() 2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
(4)T℃时,用H2还原CuCl制备活性铜:H2(g)+2CuCl(s)![]() 2Cu(s)+2HCl(g),达到平衡时,H2的转化率(
2Cu(s)+2HCl(g),达到平衡时,H2的转化率(![]() )为80%。反应速率v=v正-v逆=
)为80%。反应速率v=v正-v逆=![]() ,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当
,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当![]() =60%时,
=60%时,![]() =________(保留1位小数)。
=________(保留1位小数)。
(5)CuCl溶于浓氨水的反应原理为CuCl+2NH3·H2O![]() [Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
[Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是:
A. 此时水的离子积Kw=1×10-14 B. 水电离出的c(H+)=1×10-10molL-1
C. 水的电离程度随温度升高而增大 D. c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得25℃、101 kPa时,1 mol甲醇完全燃烧释放726.51kJ的热量,下列热化学方程式书写正确的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其原理如图所示,电极C1、C2为惰性电极,下列说法正确的是( )

A. C1极上发生还原反应
B. Y为电源的负极
C. 若有1molNO3-被还原,则有1molH+通过质子膜迁移至阴极区
D. 若有机物为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应进行到一定程度时,反应物、生成物浓度均不再改变这是因为
A. 反应停止了B. 某种反应物已完全反应
C. 正反应速率和逆反应速率相等D. 反应物和生成物的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com