
【题目】无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:

已知信息如下:①将金属锡熔融,通人干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____,E中冷水的作用是 ___。
(2)装置F中盛放的最佳试剂为 ___,作用是____。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为 __。
(5) Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是 _______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____(用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________(用离子方程式表示)。
【答案】检查装置气密性 冷凝,SnC14气体使其变为液体 浓硫酸 吸收G中挥发的水蒸气,防止进入E中导致SnC14水解 装置F液面上方出现黄绿色气体 SnCl4+(x+2)H2O=SnO2xH2O↓+4HCl 通入过量的Cl2 ![]() % 4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)
% 4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)
【解析】
由图可知,装置A制取氯气,由于浓盐酸易挥发,产生的氯气里含有氯化氢气体及水蒸气,B装置试剂为饱和食盐水除去氯化氢,C装置试剂为浓硫酸吸收水蒸气,装置D生成SnC14,在装置E中冷却后收集,未反应的氯气用氢氧化钠溶液在G中吸收,防止污染空气,因SnC14极易水解,应防止G中产生的水蒸气进入E中,所以在E与G之间设置装有浓硫酸的装置F。据以上分析解答。
(1)为防止实验中氯气泄漏污染空气及水蒸气等进入装置影响产品纯度,实验之前必需要检查装置气密性。由题知SnC14的沸点较低,用冷水冷凝SnC14气体使其变为液体以便于收集。
答案为:检查装置气密性;冷凝SnC14气体使其变为液体。
(2)由题知SnC14极易水解,为防止G中产生的水蒸气进入E中,在E与G之间设置装有浓硫酸的装置F。
答案为: 浓硫酸;吸收G中挥发的水蒸气,防止进入E中导致SnC14水解。
(3)由于Sn与空气中的氧气反应,SnC14在空气中极易水解生成SnO2.xH2O,所以制备SnC14之前用Cl2排尽装置中的空气,当观察到装置F液面上方出现黄绿色气体时,表明装置中空气已排尽,可以点燃D处酒精灯进行反应。
答案为:装置F液面上方出现黄绿色气体。
(4)若撤去装置C,则装置D中SnC14会发生水解,反应方程式为:SnCl4+(x+2)H2O=SnO2xH2O↓+4HCl。
答案为:SnCl4+(x+2)H2O=SnO2xH2O↓+4HCl。
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可以通入过量的Cl2 。
答案为:通入过量的Cl2。
(6)根据SnCl2+2HCl+I2=SnC14+2HI可得:n(SnCl2)=n(I2)=cmolL0.02L=0.02cmol,m(SnCl2)=0.02cmol190g/mol=3.80cg,产品中SnCl2的质量分数为:![]() 100%=
100%= ![]() %,若此法测定的操作均正确,但测得的SnCl2含量仍低于实际产量,其原因可能是I-被空气中的氧气氧化为I2,使消耗的碘标准溶液体积偏小,产品中SnCl2含量偏低,发生的反应为:4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,发生反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)。
%,若此法测定的操作均正确,但测得的SnCl2含量仍低于实际产量,其原因可能是I-被空气中的氧气氧化为I2,使消耗的碘标准溶液体积偏小,产品中SnCl2含量偏低,发生的反应为:4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,发生反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)。
答案为:![]() %;4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)。
%;4I-+4H++O2=2I2+2H2O(或者是Sn2+被空气中的氧气氧化为Sn4+,反应的离子方程式为:2Sn2++4H++O2=2Sn4++2H2O)。


科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加 | 有气体生成,溶液呈血红色 | 稀硝酸将 |
B | 将铜粉加 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C |
| 溶液变红 |
质 |
D | 取少量绿矾 | 溶液未变红色 | 绿矾未因氧化而变质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。_________________
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
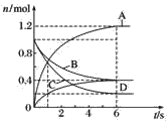
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
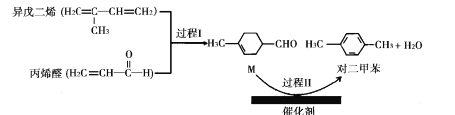
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
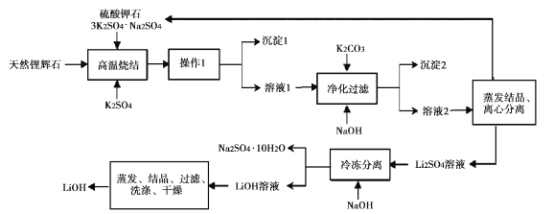
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
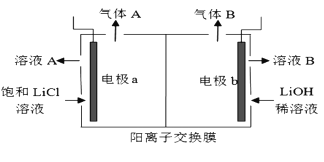
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:
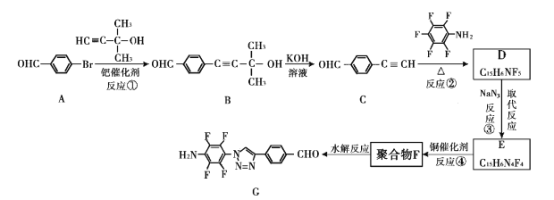
已知:![]()
(1)A生成B的反应类型是____。
(2)关于B和C,下列说法正确的是____(填字母序号)。
a 利用核磁共振氢谱可以鉴别B和C b B不能发生消去反应 c 可用酸性高锰酸钾溶液检验C中含醛基
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为 ___。
(4)反应②的化学方程式为 ___。
(5)请根据以上流程,并推测聚合物F所具有的特殊结构,下列关于聚合物F的结构说法正确的是___
A F中必含 -CH2=N- 结构
B F中必含 -N=N- 结构
C F的结构可能是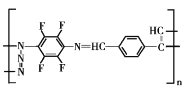
(6)H是比A多一个碳原子的同系物。H的同分异构体中符合下列条件的有 ___种。
①苯环上有三个取代基 ②能和FeCl3发生显色反应
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:___
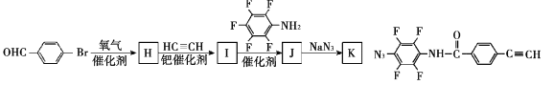
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室用自来水制取蒸馏水的实验中,下列说法正确的是( )
A.蒸馏烧瓶中加满自来水并放入几粒沸石
B.冷凝水应该是下进上出,与蒸气的流向相反
C.开始蒸馏时,应该先加热,再通冷凝水
D.蒸馏完毕时,应该先停止通冷凝水再撤酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com