
| A、醋、味精--调味品 |
| B、酒精、汽油--易燃液体 |
| C、Na+、Fe3+--人体所需微量元素 |
| D、废塑料瓶、铝制易拉罐--可回收垃圾 |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
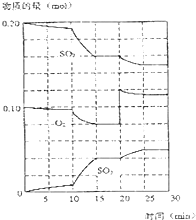 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B、汽油、柴油和植物油都是碳氢化合物 |
| C、只由一种元素组成的物质,一定是纯净物 |
| D、化学反应的实质就是旧化学键的断裂、新化学键形成过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中滴入酚酞溶液,溶液变红:NH3?H2O═NH4++OH- |
| B、90℃时,测得纯水中c(H+)?c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 |
| C、FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| D、向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蓄电池放电时,电路中每转移2mol电子,最多有1mol PbO2被还原 |
| B、电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C、电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D、蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
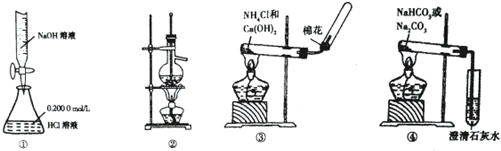
| A、用图①所示装置测定NaOH的浓度 |
| B、用图②所示装置分馏少量石油 |
| C、用图③所示装置在实验室制备收集氨气 |
| D、用图④所示装置鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
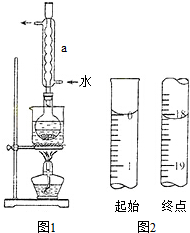 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com