
 下列说法正确的是
下列说法正确的是
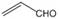 A.乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应
A.乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛( )不是同系物,学科 网它们与氢气充分反应后的产物也不是同系物
C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1molH2O2放出热量98kJ,在含少量I—的溶液中,H2O2分解的机理为:
 H2O2+I-
H2O2+I- H2O+IO- 慢; H2O2+IO-
H2O+IO- 慢; H2O2+IO- H2O+O2+I- 快
H2O+O2+I- 快
A.反应速率与I—浓度有关 B.IO—也是该反应的催化剂
C.反应活化能等于98kJ/mol D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式__________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-23.9kJ/mol
甲醇制烯烃反应 2CH3OH(g)=C2H4(g)+2H2O(g) △H=-29.1kJ/mol
乙醇异构化反应 C2H5OH(g)=CH3OCH3(g) △H=+50.7kJ/mol
则乙烯气相直接水合反应C2H4(g)+2H2O(g)= C2H5OH(g)的△H=________kJ/mol,与间接水合法相比,气相直接水合法的优点是___________________________。
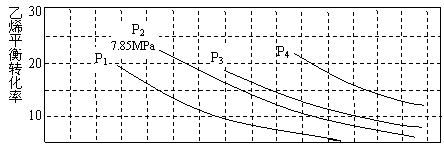
(3)下图为气相水合法中乙烯的平衡转化率与温度、压强的关系(n(H2O):n(C2H4)=1:1)。
 |
|
①列算式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______________
_____________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(P1、P2、P3、P4)的大小顺序为___________,理由是_________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃、
压强6.9MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变温度和压强外,还可以采取的措施有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)  CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)  CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是 。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
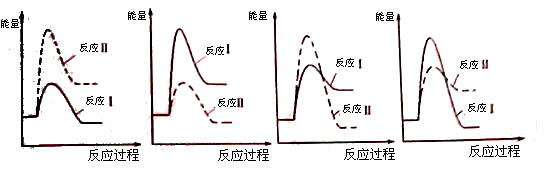
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
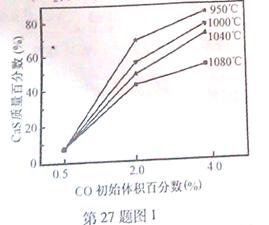
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中属于纯净物的一组是 ( )
①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥漂白粉 ⑦二甲苯 ⑧TNT ⑨溴苯 ⑩C5H10 ⑪含氧40%的氧化镁 ⑫花生油 ⑬福尔马林 ⑭密封保存的NO2气体 ⑮CuSO4·5H2O ⑯KAl(SO4)2·12H2O ⑰聚氯乙烯 ⑱液氯
A.②③④⑥ B.⑦⑩⑫⑬⑭⑮⑯
C.①⑧⑨⑪⑮⑯⑱ D.①④⑧⑨⑪⑫⑰⑱
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
知识点一 胶体的性质
(1)稀豆浆、硅酸、氯化铁溶液均为胶体 ( )
(2013·四川理综,2B)
(2)H+、K+、S2-、Br-能在Fe(OH)3胶体中大量共存 ( )
(2013·安徽理综,9C)
(3)向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 ( )
(2012·山东理综,8B)
(4)向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
( )
(2011·北京理综,9C)
(5)沸水中滴加适量饱和FeCl3溶液, 形成带电的胶体,导电能力增强 ( )
形成带电的胶体,导电能力增强 ( )
(2012·重庆理综,10D)
(6)“血液 透析”利用了胶体的性质 ( )
透析”利用了胶体的性质 ( )
(2012·四川理综,6C)
(7)葡萄糖注射液不能产生丁达尔效应,不属于胶体 ( )
(2011·山东理综,9D)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质 ②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤
C.①②③④  D.①②③④⑤
D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com