
| 1000ρw |
| M |
| M |
| n |
| 1000×1.1×20% |
| 36.5 |
| 28 |
| 28+51 |
| 7g |
| 0.125mol |
| 12.75g |
| 0.125mol |
| 102-16×3 |
| 2 |


科目:高中化学 来源: 题型:
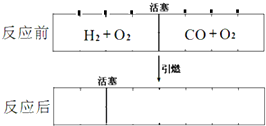 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)| A、①② | B、②④ | C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
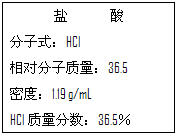 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
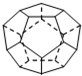 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有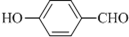 的沸点比
的沸点比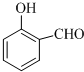 高,其原因是
高,其原因是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com