
分析 (1)可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答;
(2)①金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,根据n=$\frac{m}{M}$计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据提供的电子物质的量与二者质量之和列方程计算x、y的值,据此解答;
②根据c=$\frac{1000ρω}{M}$计算该浓硝酸的物质的量浓度;
③根据n=$\frac{V}{V{\;}_{m}}$计算NO2和N2O4混合气体的物质的量,设二氧化氮的物质的量为amol,根据电子转移列方程计算;
④反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积.
解答 解:(1)NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,对该反应来说,若NO2剩余,则实际是NO,由3NO2+H2O=2HNO3+NO可知,剩余NO气体是5mL,说明剩余的NO2为:5mL×3=15mL,其余的35mL气体中V(NO2):V(O2)=4:1,则混合气体中氧气的体积为:35mL×$\frac{1}{5}$=7mL,二氧化氮的体积为:50mL-7mL=43mL,则原混合气体中NO2和O2体积比为:43mL:7mL=43:7;
若剩余气体是O2,则反应的45mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:45mL×$\frac{4}{5}$=36mL,氧气为:50mL-36mL=14mL,
则原混合气体中NO2和O2体积比为:36mL:14mL=18:7,
故答案为:18:7; 43:7;
(2)①金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得x=0.02,y=0.01,故合金中铜与镁的质量之比是:2:1;
故答案为:2:1;
②该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为:$\frac{1000×1.4×63%}{63}$=14.0mol/L;
故答案为:14.0mol/L;
③NO2和N2O4混合气体的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中NO2的体积分数等于其物质的量分数为:$\frac{0.04mol}{0.05mol}$×100%=80%;
故答案为:80%;
④反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为:$\frac{0.64mol}{1mol/L}$=0.64L=640mL,
故答案为:640mL.
点评 本题考查混合物的有关计算,题目难度中等,理解反应发生的过程为解答关键,是对学生综合能力的考查,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析及化学计算能力.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
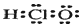
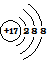

| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
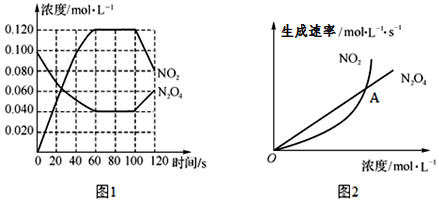
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等处理后,可转化为清洁能源 | |
| B. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 | |
| C. | 地沟油和矿物油的主要化学成分相同 | |
| D. | 聚氯乙烯可以用作食品包装袋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com