
下列有关物质的性质与应用不相对应的是( )。
A.SO2具有氧化性,可用于漂白纸浆
B.常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸
C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒
D.Zn具有还原性和导电性,可用做锌锰干电池的负极材料
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.3核素练习卷(解析版) 题型:选择题
下列各组中属于同位素关系的是( )。
A.金刚石与石墨 B.T2O与H2O C.40K与39K D.16O与16O2-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是

A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:填空题
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:

(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )。

A.X为直流电源的负极,Y为直流电源的正极
B.图中的b>a
C.阳极区pH增大
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。
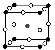
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前2 s 的平均速率v(CO)=0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(Cl2)=0.11 mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2 和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:填空题
用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下:

(1)高温下,H2S存在下列反应:2H2S(g)??2H2(g)+S2(g),其平衡常数表达式为K=________________。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是_____________________________________________________;
过滤得到的滤渣可再利用,滤渣的主要成分是________(填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80~85 ℃)下进行,其目的是_______________________________________。
Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为________________________________。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。

A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1
B.反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
C.在T2 ℃时,若反应处于状态D,则一定有v正<v逆
D.若T1 ℃、T2 ℃时的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com