
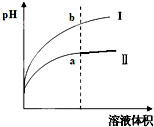


| 1 |
| 2 |


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������� ��Cu ��Һ̬SO2 �۴����� ��NaHCO3 ��Ba��OH��2��Һ
�������� ��Cu ��Һ̬SO2 �۴����� ��NaHCO3 ��Ba��OH��2��Һ H2CO3+OH-
H2CO3+OH- H2CO3+OH-
H2CO3+OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������� ��Cu ��Һ̬SO2 �۴����� ��NaHCO3 ��Ba��OH��2��Һ
�������� ��Cu ��Һ̬SO2 �۴����� ��NaHCO3 ��Ba��OH��2��Һ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�������߷������ѧ�߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��12�֣��������� ��Cu ��Һ̬SO2 �۴����� ��NaHCO3 ��Ba(OH)2��Һ
I�����ڷǵ���ʵ��� ������ţ���NaHCO3��һ�� ���ǿ��������������ʣ�
��д��HCO3�Dˮ������ӷ���ʽ�� ��
�dz����£�0.1 mol��L-1NaHCO3��Һ��pH����8������Һ��Na����HCO3�D��H2CO3��CO32�D��OH�D��������Ũ���ɴ�С��˳��Ϊ�� ��
�ȳ��³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.60��c(H2CO3)=1.5��10-5 mol��L-1��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3 HCO3-��H+��ƽ�ⳣ��K1= ������֪��10-5.60=2.5��10-6��
HCO3-��H+��ƽ�ⳣ��K1= ������֪��10-5.60=2.5��10-6��
�� ��Ba(OH)2��һ��ǿ����ʣ�����25�桢pH��13��Ba(OH)2��Һ��
����Һ����ˮ�����c(OH�D)��______________��
����ijŨ��������Һ������ȣ�������֮�ȣ�1�� 9��Ϻ�������ҺpH��11����������Һ��������ڻ��ǰ����Һ������ͣ�����������Һ��pH��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
���������ʢ�Cu����Һ̬SO2����CH3COOH����NaHCO3����Ba(OH)2��Һ��������NaCl����ϡ��ˮ����BaSO4����H2O
��1������ǿ����ʵ��� ������ţ� ����������ʵ��� ������ţ�
��2�������£�0.1 mol��L-1NaHCO3��Һ��pH����8������Һ��Na����HCO3�D��CO32�D��OH�D ��������Ũ���ɴ�С��˳��Ϊ�� ��NaHCO3ˮ������ӷ���ʽ ��
��3��Ba(OH)2��һ��ǿ����ʣ�����25�桢pH��13��Ba(OH)2��Һ��
�ٸ�Ba(OH)2��Һ�����ʵ���Ũ��Ϊ___________________��
����ijŨ��������Һ������ȣ�������֮�ȣ�1 ��9��Ϻ�������ҺpH��11����������Һ��������ڻ��ǰ����Һ������ͣ�����������Һ��pH��____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com