
 某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为
某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为| m |
| M |
| ||
| ||
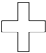 可得分子式为C12H24;该分子是对称的,有2种等效氢原子,一氯化物有2种,即能生成2种沸点不同的产物;
可得分子式为C12H24;该分子是对称的,有2种等效氢原子,一氯化物有2种,即能生成2种沸点不同的产物;| 4.2g |
| 168g/mol |
| 5.6g |
| 168g/mol |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
| A、用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下) |
| B、6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 NA |
| C、1.00 L 1.00 mol?L-1 Na2CO3溶液中,CO32-所带电荷总数为2NA |
| D、标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50×18×6.02×1023 |
| B、6.02×1023/50 |
| C、6.02×1023/50×18 |
| D、50×6.02×1023/18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
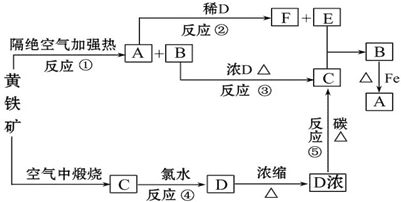
| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84% |
| SO3 | -- | 7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的PH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com