
【题目】在物质分类中,前者包括后者的是
A.含氧酸、酸B.碱、碱性氧化物
C.化合物、单质D.盐、硫酸盐
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如下图所示。Y是地壳中含量最多的元素。下列说法正确的是( )

A. 1mol Q单质与氢氧化钠溶液反应转移的电子数目为2 NA
B. X的气态氢化物能使湿润的蓝色石蕊试纸变红
C. 氢化物的沸点:H2Y>HQ
D. 最髙价氧化物的水化物的酸性:W > Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A放入密闭容器中加热,在一定条件下存在如下两个平衡:A(s)![]() 2B(g)+ C(g) ;2C(g)
2B(g)+ C(g) ;2C(g)![]() D(g)+ 3E(g)经测定,平衡时,c(C)=0.01mol/L,c(E)=0.015mol/L,则B的浓度为( )
D(g)+ 3E(g)经测定,平衡时,c(C)=0.01mol/L,c(E)=0.015mol/L,则B的浓度为( )
A. 0.04mol/LB. 0.025mol/LC. 0.03mol/LD. 0.02mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
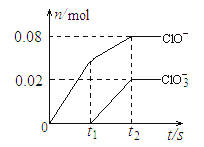
A. 苛性钾溶液中KOH的质量是5.6 g B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2 D. 一定有3.136 L氯气参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B![]() AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1mol·L-1的A、B溶液各10mL ④0.5mol·L-1的A、B溶液各50mL
四者反应速率的大小关系是
A. ①>②>③>④ B. ④>③>②>①
C. ①>②>④>③ D. ②>①>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金在生产和生活具有广泛的应用。下列用品中所用的材料不属于合金的是
A. 铁锅 (生铁) B. 铜壶(黄铜)
C. 高压锅(硬铝) D. 温度计(水银)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。

(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.

(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com