


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
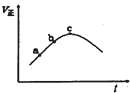 向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、该反应正反应为吸热反应 |
| B、反应物的浓度:a点小于b点 |
| C、反应在c点达到平衡 |
| D、反应达到平衡时,升高温度,逆反应速率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧氧化法可以对有机物进行定性与定量的元素分析 |
| B、提纯液体混合物常用重结晶法 |
| C、核磁共振氢谱可以用于确定有机物的结构 |
| D、常用质谱法进行有机物相对分子质量的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有AgBr沉淀生成 |
| B、AgCl和AgBr沉淀都有,但以AgCl沉淀为主 |
| C、AgCl和AgBr沉淀等量生成 |
| D、AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡一定向正反应方向发生了移动 |
| B、平衡一定向逆反应方向发生了移动 |
| C、反应物浓度相应减小 |
| D、平衡可能发生了移动,也可能没有发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com