
| +O2 |
| +H2O |
| +NaOH或HCl |
| A.硅 | B.硫 | C.碳 | D.钠 |
科目:高中化学 来源:不详 题型:填空题
| A.金属;C |
| B.陶瓷;SiO2 |
| C.合成树脂;SiO2、Al2O3、MgO |
| D.合成树脂;C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.碳酸钠可用作食用碱,是利用了其溶液显碱性 |
| B.氢氟酸可用于刻蚀玻璃,是利用Si02酸性氧化物的性质 |
| C.常温下可用铝制容器盛装浓硫酸,是利用浓硫酸的强氧化性 |
| D.在食品包装袋中放人硅胶防止食品变质,是利用硅胶的吸水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.单质硅可用于制造光纤和太阳能电池 |
| B.在常温下可用铝制容器贮藏运输浓硫酸 |
| C.纯碱可作治疗胃酸过多的一种药剂 |
| D.SO2可用于漂白一切有色物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅单质可用来制造太阳能电池 |
| B.装碱性溶液的玻璃试剂瓶不能用玻璃塞 |
| C.二氧化硅是制造光导纤维的材料 |
| D.二氧化硅属于酸性氧化物,不能与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)mol?L-1 | c(CO2)mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)______v(逆) |
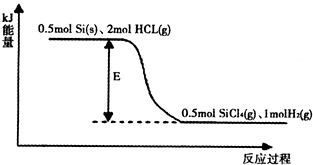
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com