
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
分析 反应后气体的体积是反应前的四分之一,说明反应完毕后气体有剩余,剩余的气体可能是二氧化硫,也可能是硫化氢,据此结合方程式2H2S(g)+SO2(g)=3S↓+2H2O计算.
解答 解:反应后气体的体积是反应前的$\frac{1}{4}$,说明反应完毕后气体有剩余,
若剩余的气体是二氧化硫,则:
2H2S(g)+SO2(g)=3S↓+2H2O
2 1
bL 0.5bL
故剩余二氧化硫为(a-0.5b)L,由题意可知:$\frac{(a-0.5b)L}{(a+b)L}$=$\frac{1}{4}$,整理得a:b=1:1,
若硫化氢有剩余,则:
2H2S(g)+SO2(g)=3S↓+2H2O
2 1
2aL aL
剩余硫化氢为(b-2a)L,由题意可知:$\frac{(b-2a)L}{(a+b)L}$=$\frac{1}{4}$,整理得a:b=1:3,
故选AD.
点评 本题考查混合物计算,由于不能确定剩余气体成分,需要讨论计算,注意根据方程式计算,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
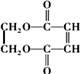 的合成路线如图:
的合成路线如图: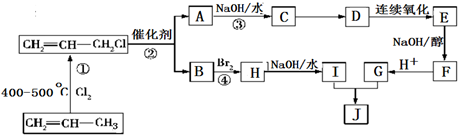
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
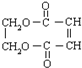
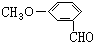 ,有多种同分异构体,其中属于芳香酸的结构简式为:
,有多种同分异构体,其中属于芳香酸的结构简式为: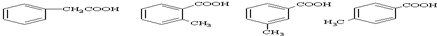 、;
、; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)═c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
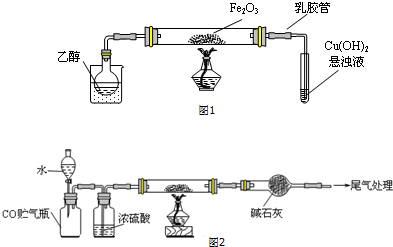
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com