
| A、正极上发生的反应是:O2+4e-+2H2O═4OH- | ||||
B、该电池反应的化学方程式为:CH3CH2OH+3O2
| ||||
| C、检测时,电解质溶液中的H+向正极移动 | ||||
| D、若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |


科目:高中化学 来源: 题型:
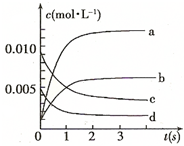 (14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N O)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)>c(Na+)+c(H+) |
| B、由水电离出的c(OH-)=1.0×10-12mol?L-1 |
| C、与等体积pH=2的醋酸混合后所得溶液显碱性 |
| D、与等体积0.01mol?L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、4.5 | C、5.5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )
X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )| A、X的氢化物的水溶液显碱性 |
| B、Y和Z只能组成一种化合物 |
| C、Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 |
| D、最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.500mol/L的溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷、乙醇、乙二醇 |
| B、苯、苯酚、苯乙烯 |
| C、甲醛、乙酸、甲酸甲酯 |
| D、甲烷、乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③ |
| C、①④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com