
| A、NH4HCO3和醋酸溶液不能发生反应 |
| B、0.1mol NH4HCO3粉末中NH4+和HCO3-总数小于1.204×1023 |
| C、醋酸凝固时释放的能量储存于NH4Cl、CO2和H2O中 |
| D、如果改加体积和pH值均与盐酸相同的稀硫酸,可能不会发生上述现象 |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
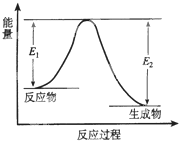 反应A(g)+B(g)?C(g)+D(g) 发生过程中的能量变化如右图,△H 表示反应的焓变.下列说法正确的是( )
反应A(g)+B(g)?C(g)+D(g) 发生过程中的能量变化如右图,△H 表示反应的焓变.下列说法正确的是( )| A、该反应为吸热反应 |
| B、反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| C、反应体系中加入催化剂,反应速率增大,△H不变 |
| D、反应达到平衡时,降低温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12有2种同分异构体 |
| B、C8H10中只有三种属于芳香烃的同分异构体 |
| C、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| D、CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ |
| B、碳酸钠溶液中加入少量稀盐酸 2 H++CO32-=CO2↑+H2O |
| C、用FeCL3溶液腐蚀铜板制印刷电路 2Fe3++Cu=2Fe2++Cu2+ |
| D、稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na,Mg,Al金属性依次减弱 |
| B、HCl,H2S,PH3稳定性依次减弱 |
| C、NaOH,KOH,CsOH碱性依次减弱 |
| D、S2-,Cl-,Ca2+半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、族序数等于其周期序数的元素一定是金属元素 |
| B、13C与14C互为同位素,它们的化学性质相同,但相对原子质量不同 |
| C、元素原子的最外层电子数等于元素的最高化合价 |
| D、全部由非金属元素组成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+):③>② |
| B、pH:①>②>③ |
| C、Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)向溶解方向移动 |
| D、等体积①和③混合溶液中 c(Cl-)>c(NH4+)>c(H+)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
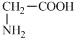 ⑥
⑥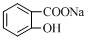
| A、全部 | B、①②④⑤⑥ |
| C、②③④⑤⑥ | D、②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com