
【题目】在一定温度下,可逆反应X(g)+3Y(g) ![]() 2Z(g) 达到平衡的标志是( )
2Z(g) 达到平衡的标志是( )
A. 单位时间内生成 1 molX,同时生成 3 molY
B. X, Y, Z的浓度相等
C. X, Y, Z的分子数比为1:3:2
D. 单位时间内生成 1 molX,同时生成2 molZ
【答案】D
【解析】当反应达到平衡状态时,正逆反应速率相等,各组分的浓度、质量、体积分数以及百分含量不变,据此分析判断。
A.无论该反应是否达到平衡状态,只要单位时间内生成1molX,一定同时生成3molY,所以不能确定该反应是否达到平衡状态,故A错误;B.当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,X, Y, Z的浓度相等,不能说明浓度是否变化,所以不能确定该反应达到平衡状态,故B错误;C.当X、Y、Z的分子数之比为1:3:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始浓度和转化率有关,故C错误;D.单位时间内生成nmolX,同时生成2nmolZ,表示正逆反应速率相等,说明是平衡状态,故D正确;故选D。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
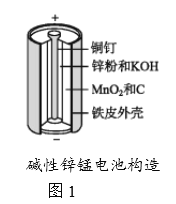
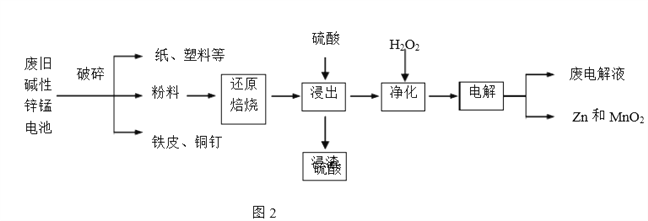
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
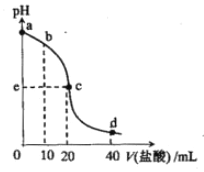
A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出。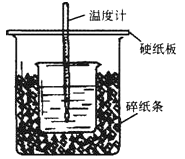
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤
B.①②③④
C.②③④⑤
D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”或“不相等”),所放出的热量(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会(填“偏大”、“偏小”或“无影响”).
(5)(Ⅱ)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式 。
(7)化学反应N2+3H2 ![]() 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。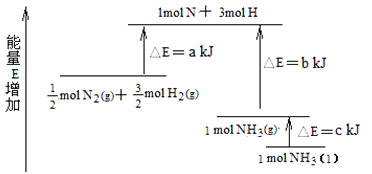
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | 氯化钠 | 水 | 氯气 |
B | 硫酸 | 碳酸钙 | 四氯化碳 |
C | 氯化银 | HD | 蔗糖 |
D | 氢氧化钡 | 次氯酸 | 乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是( )
A.称量时部分MgSO4吸收了水蒸气
B.定容时俯视容量瓶上的刻度线
C.洗涤后的容量瓶中有少量水珠
D.溶解过程中有少量的溶液溅出烧杯外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com