
下列物质在水溶液中的电离方程式书写正确的是( )
A.CH3COOH===H++CH3COO-
B.NaHSO4===Na++H++SO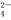
C.H3PO4 3H++PO
3H++PO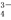
D.NaHCO3 Na++H++CO
Na++H++CO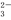
科目:高中化学 来源:2016-2017学年辽宁省协作校高二上学期期中化学卷(解析版) 题型:选择题
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
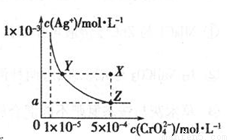
A.向饱和Ag2CrO4溶液中加入固体K2CrO4能使溶液由Y点变为X点
B.T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
C.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
D.图中a=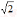 ×10-4
×10-4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:选择题
铁粉在高温下可与水蒸气反应。若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g。则参加反应的铁粉的物质的量是( )
A.0.5mol B.1mol C.1.5mol D.2mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
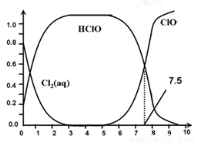
A.Cl2(g)+ H2O 2H+ + ClO- + Cl- K=10-10.9
2H+ + ClO- + Cl- K=10-10.9
B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D.氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始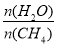 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时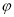 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
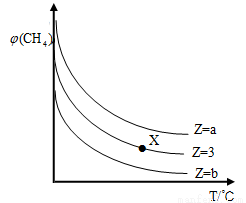
A.该反应的焓变△H﹤0
B.图中Z的大小为b >3> a
C.图中X点对应的平衡混合物中 =3
=3
D.温度不变时,图中X点对应的平衡在加压后 (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:实验题
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
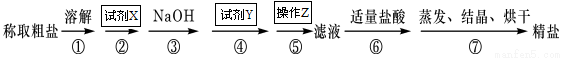
(1)试剂X的化学式为: ,试剂Y的化学式为: ,操作Z的名称: 。
(2)判断试剂X已过量的方法是
(3)第④步中,有关的离子方程式是 。
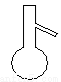
(4)下列仪器中,蒸发结晶时会用到的是 (写仪器名称)
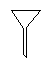
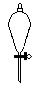
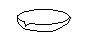
(5)为检验精盐纯度,需配制1000mL 0.2 mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶。其正确的操作顺序应是_______ (填序号)。
A.B E F G C G D H A B.B E G A C G F D H
C.B E A G C G D F H D.B E A G C G D H F
②若定容时,仰视,会造成所配制的溶液浓度(填“偏高”或“偏低” ) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:选择题
根据离子方程式:(1)2Fe3++2I- 2Fe2++I2,(2)Br2+2Fe2+
2Fe2++I2,(2)Br2+2Fe2+ 2Fe3++2Br-,可判断离子的还原
2Fe3++2Br-,可判断离子的还原 性从强到弱的顺序是( )
性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.F e2+、I-、Br-
e2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:实验题
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置。

(1)检查图1所示装置气密性的方法是 。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量 。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是 ;t2~t3时间段内反应速率逐渐减慢的主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:实验题
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为 0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。 回答下列问题:
回答下列问题:
(1)E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号) 。
a. b.
b.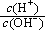 c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
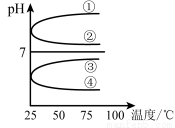
(4)将等体积、等物质的量浓度B和C混合后溶液, 升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
(5)②中C与D溶液等体积混合后溶液呈酸性的原因 (用离子方程式表示);若室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com