
【题目】(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________。
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中b极的电极反应式为_________________________; Zn极为_______极。

科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因,写出产生该物质的电极反应式:_________________________。
(2)乙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色; |
乙通过对现象分析证实了甲的观点不是溶液变绿的主要原因。乙否定甲的依据是______________。
(3)乙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]--,[CuCl2]- 掺杂Cu2+ 后呈黄色
ii. 稀释含[CuCl2]- 的溶液生成CuCl白色沉淀,据此乙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________________________________。
② 写出b中生成[CuCl2]- 的离子方程式:____________________________________________。
③ 补充c中必要的操作及现象:____________________________________________。
乙据此得出结论:电解时阴极附近生成[CuCl2]- 是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下 (图中虚线表示氢键)。下列说法不正确的是( )
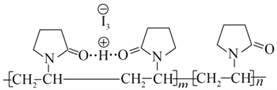
A. 聚维酮的单体是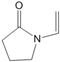 B. 聚维酮分子的聚合度为2m+n
B. 聚维酮分子的聚合度为2m+n
C. 聚维酮在NaOH水溶液中水解可生成 D. 聚维酮和聚维酮碘都是水溶性的
D. 聚维酮和聚维酮碘都是水溶性的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题中信息完成下列填空题
(1)黄绿色气体单质X,与标况下密度为1.25g/L的烯烃Y发生加成反应,请写出烯烃Y的结构式__________。写出该加成产物的所有同分异构体结构简式______________。
(2)125℃,101kPa的条件下,某气态烯烃在氧气中充分燃烧后,气体体积没有变化,求出该烯烃的分子式________。
(3)某元素X的一种核素质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是___________mol。
(4)E和F均含有18个电子的微粒,E是所有18电子微粒中氧化能力最强的分子,请你写出E与水发生的化学反应方程式_______________。F是有两种元素组成的三原子分子,将其通入足量的NaOH溶液,发生的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生产生活中有广泛的应用。下列叙述正确的是
A.开发新技术可将水分解成氢气、氧气并释放能量
B.研制新型催化剂可提高汽车尾气的平衡转化率
C.燃料电池能将化学能完全转化为电能
D.为防止金属管道被腐蚀,应将金属管道与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
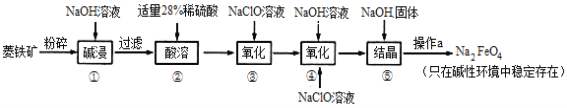
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确的是
A. 32.5 g Zn与一定量浓硫酸完全反应,生成的气体分子数目小于0.5NA
B. 2H2S+SO2 = 3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1 : 2
C. 将NO2和O2等体积混合充满试管,倒置于水槽中充分反应,试管中剩余气体占试管容积的1/8
D. 常温常压下(Vm=24.5L/mol),用排空气法收集HCl气体于干燥烧瓶做喷泉实验,假设烧瓶内溶液不外溢,所得盐酸的物质的量浓度为1/24.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com