
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3
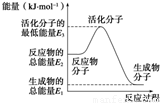
B.H2的燃烧热为241.8 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:选择题
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第二次月考化学试卷(解析版) 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮的原子结构示意图为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -195kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极生成无污染的气体,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省杭州市高二下学期第一次质量检测化学试卷 题型:填空题
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。
N-H键的键能是 。
(2)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
N2 (g)+2O2 (g) = 2NO2 (g) △H1=+67.7 kJ·mol-1;
N2H4 (g)+O2 (g) = N2 (g)+2H2O(g) △H2=-534 kJ·mol-1;
H2O(L) = H2O(g) △H3=+44.0 kJ·mol-1。
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式 :
__________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com