
【题目】用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是( )
A.给反应体系适当加热
B.向反应体系中加水稀释
C.加入少量氧化铜固体
D.加压
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
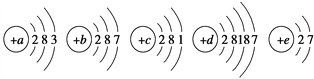
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为____________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(3)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:
n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种元素,A、B同周期,A、B可形成两种无色无味气体AB和AB2。D在B的下一周期,其最高价氧化物的水化物是二元强酸,D、C可形成离子化合物CD,D离子比C离子多一个电子层。据此可知:
(1)这四种元素分别是A:______、B:_____、C:_____、D:_____。
(2)C离子的离子结构示意图是____________________。
(3)化合物CD的电子式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等。甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示。


图1 图2
(1)①事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填序号,下同)。
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)=2H2O(l) ΔH<0
c.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
②甲同学设计的原电池,若将石墨棒改为铁片,则总电极反应式是否改变,若是,写出改变后总的电极反应式,若否,请写出理由:_______________________。
③乙同学设计的原电池电极反应与甲的相同,但电池的效率高很多。乙同学设计的原电池两电极分别为:a是_______(填“铜片”“铁片”或“石墨棒”,下同),b是__________。负极的电极反应式为___________________,正极的电极反应式为____________________。
(2)关于乙同学设计的原电池,下列说法中错误的是____________。
a.实验过程中,左侧烧杯中Cl浓度增大
b.实验过程中取出盐桥,原电池不能继续工作
c.电子通过盐桥从右侧烧杯进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有①Na+ 、②Ba2 +、③Cl一、④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。

下列结论正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑥
C. 不能确定的离子是① D. 不能确定的离子是③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
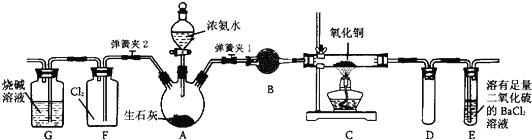
(1)在组装好装置后,若要检验A—E装置的气密性,其操作是首先 ,然后微热A,察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好。
(2)装置B中盛放试剂是 。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式 。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是 (用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式 。迅速产生倒吸的原因是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com