
| Ԫ�� | T | X | Y | Z | W |
| ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| �����ͻ��ϼ� | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |






 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | T | X | Y | Z | W |
| ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| �����ͻ��ϼ� | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |



 NH3?H2O
NH3?H2O NH4++OH-��NaOH����ˮ�����OH-��ʹƽ�������ƶ������ܽ�ʱ�ų�������ʹNH3���ܽ�ȼ�С
NH4++OH-��NaOH����ˮ�����OH-��ʹƽ�������ƶ������ܽ�ʱ�ų�������ʹNH3���ܽ�ȼ�С NH3?H2O
NH3?H2O NH4++OH-��NaOH����ˮ�����OH-��ʹƽ�������ƶ������ܽ�ʱ�ų�������ʹNH3���ܽ�ȼ�С
NH4++OH-��NaOH����ˮ�����OH-��ʹƽ�������ƶ������ܽ�ʱ�ų�������ʹNH3���ܽ�ȼ�С�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ֶ�����Ԫ�صIJ��������������£�
| Ԫ�� | T | X | Y | Z | W |
| ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
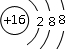
| �����ͻ��ϼ� | +1 | +5 ��3 | +7 ��1 | +6 ��2 | +3 |
��1��Z���ӵĽṹʾ��ͼΪ ��
��2������Y��Z����Ԫ�أ�����������ȷ���� ������ţ���
a�������ӵİ뾶 Y > Z
b����̬�⻯����ȶ���Y�� Zǿ
c������������Ӧˮ���������Z��Yǿ
��3��������T��X����Ԫ���γɵ�10 e�����ӣ�������Y��W����Ԫ���γɵĻ����
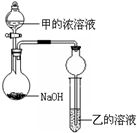
ijͬѧ�������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ�飬����Ũ��Һ��μ��뵽NaOH�����У���ƿ�м��мų���ԭ���� ��һ��ʱ��۲쵽�Թ��е������� ��������Ӧ�����ӷ���ʽ�� ��
��4��XO2�ǵ��¹⻯ѧ�����ġ�������ס�֮һ����������������Һ���յĻ�ѧ����ʽ�ǣ�2XO2 + 2NaOH = M + NaXO3 + H2O������ƽ��������M��Ԫ��X�Ļ��ϼ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ֶ�����Ԫ�صIJ��������������£�
| Ԫ�� | T | X | Y | Z | W |
| ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| �����ͻ��ϼ� | +1
| +5 ��3 | +7 ��1 | +6 ��2 | +3
|
��1��Z���ӵĽṹʾ��ͼΪ ��
��2������Y��Z����Ԫ�أ�����������ȷ���� ������ţ���
a�������ӵİ뾶 Y > Z
b����̬�⻯����ȶ���Y�� Zǿ
c������������Ӧˮ���������Z��Yǿ
��3��������T��X����Ԫ���γɵ�10 e�����ӣ�������Y��W����Ԫ���γɵĻ����
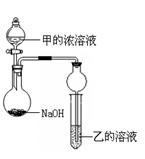
ijͬѧ�������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ�飬����Ũ��Һ��μ��뵽NaOH�����У���ƿ�м��мų���ԭ���� ��һ��ʱ��۲쵽�Թ��е������� ��������Ӧ�����ӷ���ʽ�� ��
��4��XO2�ǵ��¹⻯ѧ�����ġ�������ס�֮һ����������������Һ���յĻ�ѧ����ʽ�ǣ�2XO2 + 2NaOH = M + NaXO3 + H2O������ƽ��������M��Ԫ��X�Ļ��ϼ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�챱���г�����������һѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
���ֶ�����Ԫ�صIJ��������������£�
| Ԫ�� | T | X | Y | Z | W |
| ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| �����ͻ��ϼ� | +1 | +5 ��3 | +7 ��1 | +6 ��2 | +3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�걱���г�����������һѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
���ֶ�����Ԫ�صIJ��������������£�
|
Ԫ�� |
T |
X |
Y |
Z |
W |
|
ԭ�Ӱ뾶��nm�� |
0.037 |
0.075 |
0.099 |
0.102 |
0.143 |
|
�����ͻ��ϼ� |
+1
|
+5 ��3 |
+7 ��1 |
+6 ��2 |
+3
|
��1��Z���ӵĽṹʾ��ͼΪ ��
��2������Y��Z����Ԫ�أ�����������ȷ���� ������ţ���
a�������ӵİ뾶 Y > Z
b����̬�⻯����ȶ���Y�� Zǿ
c������������Ӧˮ���������Z��Yǿ
��3��������T��X����Ԫ���γɵ�10 e�����ӣ�������Y��W����Ԫ���γɵĻ����
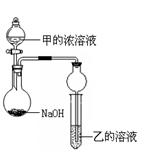
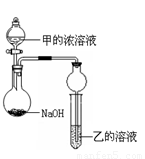
ijͬѧ�������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ�飬����Ũ��Һ��μ��뵽NaOH�����У���ƿ�м��мų���ԭ���� ��һ��ʱ��۲쵽�Թ��е������� ��������Ӧ�����ӷ���ʽ�� ��
��4��XO2�ǵ��¹⻯ѧ�����ġ�������ס�֮һ����������������Һ���յĻ�ѧ����ʽ�ǣ�2XO2 + 2NaOH = M + NaXO3 + H2O������ƽ��������M��Ԫ��X�Ļ��ϼ�Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com