
【题目】下列说法正确的是( )
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
C. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
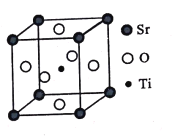
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
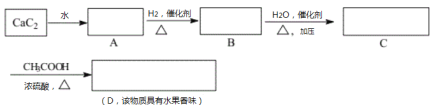
【题目】化合物甲由四种元素组成。某化学研究小组按如图流程探究其组成:

已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。请回答下列问题:
(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会_________(填“增大”、 “减小”或“不变”);微热该溶液, pH 会_________(填“增大”、 “减小”或“不变”)。
(2)Na2S 溶液中各离子浓度由大到小的顺序为: ___________________________________。
(3)向 Na2S 和 Na2SO3 的混合溶液中加入足量的稀硫酸溶液,发生以下反应:
__ Na2S+ __ Na2SO3+__ H2SO4→__ Na2SO4+__ S↓+ __ H2O
①配平上述化学方程式,标出电子转移的方向和数目______。
②反应中被氧化的元素是______________。
(4)CuS和FeS都是难溶于水的固体,工业上可用 FeS 将废水中的 Cu2+转化为CuS除去,请结合相关原理进行解释:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在方框内填入有机物的结构简式,并回答有关问题:
(1)写出A、B、C、D的结构简式:A:___________ B:____________C:___________ D:____________
(2)A→B的化学反应方程式是___________________________,反应类型是___________。
(3) C→D的化学反应方程式是___________________________,反应类型是___________。
(4)B在一定条件下可生成聚合物,其化学方程式是___________________,反应类型是_________。这种塑料会造成白色污染的原因是____________________________。
(5)A在一定条件下也可生成聚合物![]() ,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH![]() 、Cl-、AlO
、Cl-、AlO![]() 。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
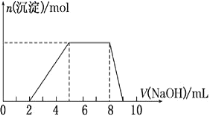
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH![]()
B.反应最后形成的溶液中的溶质含AlCl3
C.原溶液中Al3+与NH![]() 的物质的量之比为1∶3
的物质的量之比为1∶3
D.原溶液中含有的阴离子是Cl-、AlO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种物质①熔融的氢氧化钠②蔗糖③纯净的盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧偏铝酸钠溶液⑨酒精溶液⑩液氨(注意:下面前三问的答案请填序号!)
(1)属于电解质的有__。
(2)属于非电解质的有__。
(3)上述状态下的电解质能导电的有__。
(4)偏铝酸钠溶液中通足量二氧化碳反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下,分别测得反应2SO2(g)+O2(g)![]() 2SO3(g)的化学反应速率,其中表示该反应进行得最快的是( )
2SO3(g)的化学反应速率,其中表示该反应进行得最快的是( )
A. υ(SO2)=4 mol·L-1·min-1B. υ(O2)=3 mol·L-1·min-1
C. υ(SO2)=0.1 mol·L-1·s-1D. υ(O2)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常温下呈液态,熔点-33℃,沸点144℃,在潮湿的空气中能强烈水解生成金属氧化物并产生有刺激性的白色烟雾,可用作媒染剂、催化剂等。实验室利用如图所示装置制备四氯化锡(夹持装置略)。
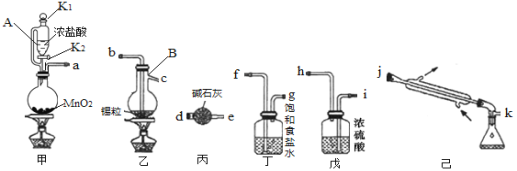
回答下列问题:
(1)甲装置中发生反应的离子方程式为_________,仪器B的名称是_____。
(2)按照气流方向连接装置,接口顺序为_________。
(3)实验开始时需向圆底烧瓶中缓慢滴加浓盐酸,此时应打开仪器A的活塞_____(填“K1”、“K2”或“K1和K2”)。排尽装置中的空气后才能点燃乙处的酒精灯,判断装置中空气已排尽的现象是______。实验结束时,应先停止加热的装置是_____(填“甲”或“乙”)。
(4)丙装置的作用是_____,若没有丙装置,可能发生的化学反应方程式为____。
(5)实验制得30g溶有氯气的SnCl4,其中氯气质量分数为13.0%,则至少需向乙中通入标准状况的氯气_______L (保留2位小数) 。提纯该SnCl4的方法是______(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com