
| 量筒量取浓盐酸体积/mL | 应选用量筒的规格(可供选择的规格10mL、25mL、50mL) | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
| ①2.1mL | ②25 mL | ③250 mL | ④烧杯、玻璃棒、胶头滴管、量筒 |
分析 (1)根据c=$\frac{1000ρw}{M}$计算出浓盐酸的物质的量浓度,再根据稀释定律计算所需浓盐酸的体积;
根据所配溶液的体积选择容量瓶的规格;
根据配制溶液的实验操作步骤选择所需仪器;
(2)(3)根据配制步骤有查漏、称量、溶解、移液、洗涤、定容、摇匀等操作来分析;
(4)分析操作对溶质的物质的量、溶液的体积的影响,根据c=$\frac{n}{V}$判断对浓度的影响.
解答 解:(1)浓盐酸的物质的量浓度=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
配制250mL0.1mol•L-1的盐酸溶液,故需要250mL容量瓶,
令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,可用10ml量筒量取,
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,
故答案为:
| 量筒量取浓盐酸体积/mL | 应选用量筒的规格(可供选择的规格10 mL、25 mL、50 mL) | 应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL) | 除容量瓶外还需要哪些玻璃仪器 |
| ①2.1 mL | ②10 mL | ③250 mL | ④烧杯、玻璃棒、胶头滴管、量筒 |
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,易错题是(1)题,注意需要120mL溶液,因为没有120mL的容量瓶,有250mL的容量瓶,所以要配制250mL溶液,所量取溶液的体积应等于配制250mL溶液时所用的量.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解氯化镁溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+2OH- | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2=2NH4++SO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.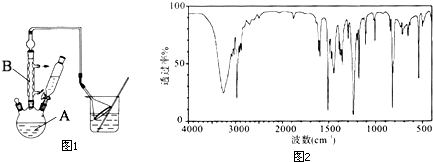
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1 mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O与0.1 mol C6H12O6 | |
| D. | 0.2mol SO3与0.3mol SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com