
【题目】下列过程属于物理变化的是
A. 平行光照射胶体产生丁达尔效应 B. 紫外线照射下,液态蛋白质凝固
C. 铁在潮湿的空气中生锈 D. 铝遇到冷的浓硝酸发生钝化
科目:高中化学 来源: 题型:
【题目】(1)FeCl3的水溶液显________(“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_________________________________________;
(2)实验室配制FeCl3的溶液时,常将固体FeCl3先溶于_____中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干、灼烧,最后得到的主要产物是____________
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)________________________________;
(5)Al2S3为什么不能用Na2S溶液和AlCl3溶液制备(用离子方程式解释)__________________;
(6)将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④50mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )

A. 氯化钾 B. 烧碱 C. 熟石灰 D. 硫酸亚铁(水溶液显性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O4![]() 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O![]() 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_______________。
(2)该循环制氢中不断消耗的物质是________(填化学式),得到H2和O2的质量比为_______________。
(3)氢气作为新能源的优点有________(任写一点)。该循环法制氢的不足之处是________________________________________________。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+ 3H2![]() 3MgH2+MgCu2
3MgH2+MgCu2
(4)熔炼制备Mg2Cu合金时,通入氩气的目的是_________________。
(5)氢化物MgH2与水反应生成一种碱,并释放出H2。 其化学反应方程式为___________________________。
(6)11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳捕捉技术即是二氧化碳的捕集、利用与封存(CCUS),是实现温室气体减排的重要途径之一,更是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
I.利用CO2加氢合成低碳烯烃技术就是重要的应用之一。以合成C2H4为例,其合成反应为:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
(1)ΔH1=__________________(请用△H2、△H3、△H4表示),若将1mol CO2与3mol H2充入10L的恒容密闭容器中,达到平衡后,平衡浓度、CO2转化率与温度的关系分别如图1和图2所示,请回答下列问题:


(2)图1中曲线c代表物质的电子式___________________。
(3)该反应在较低温度时能自发进行,请分析其原因:______________________________。
(4)结合图1和图2,下列说法一定正确的是 __________。
A.其他条件不变,T1℃、增大压强,再次达到平衡时c(H2)比A点的c(H2)大
B.平衡常数:KM>KN
C.生成乙烯的速率:v(M)小于v(N)
(5)计算图2中M点时,乙烯的体积分数________________。(保留二位有效数字)
II.利用电解法也可将CO2制得乙烯,如图3所示,电极b是太阳能电池的________极,
电解时其中a极对应电解槽上生成乙烯的电极反应式为______________________________。
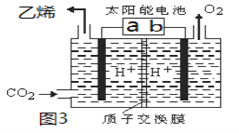
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的重要原料,新旧合成方法如下:
旧合成方法:(CH3)2C=O+HCN![]() (CH3)2C(OH)CN
(CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4 ![]() CH2=C(CH3)COOCH3+NH4HSO4
CH2=C(CH3)COOCH3+NH4HSO4
新合成方法:CH3C![]() CH+CO+CH3OH
CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列叙述中,正确的是
A. 甲基丙烯酸甲酯属于高分子 B. 新合成方法的原料无爆炸危险
C. 新合成方法的原料利用率高 D. 新合成方法的原料都是无毒物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)负极的电极反应式是________,该反应属于_______ (填“氧化”或“还原”)反应。
(2)电子由________(填“锌片”或“铜片”)沿导线流出。
(3)当铜表面析出0.224 L氢气(标准状况)时,导线中通过了________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是( )
A.溶解、过滤、蒸发、洗涤
B.溶解、过滤、洗涤、烘干
C.溶解、蒸发、洗涤、过滤
D.溶解、洗涤、过滤、烘干
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com