
 时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥
时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥ 时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,结合反应物物质的量之间的关系解答该题.
时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,结合反应物物质的量之间的关系解答该题. 时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥
时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥ 时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,
时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化, ~
~ ,当Fe2+被完全氧化时需要0.5mol氯气,剩下0.7mol氯气氧化1.4mol溴离子,还有0.6mol溴离子未被氧化,所以其反应方程式为:10Fe2++14Br-+12Cl2=7Br2+10Fe3++24Cl-,故B错误;
,当Fe2+被完全氧化时需要0.5mol氯气,剩下0.7mol氯气氧化1.4mol溴离子,还有0.6mol溴离子未被氧化,所以其反应方程式为:10Fe2++14Br-+12Cl2=7Br2+10Fe3++24Cl-,故B错误; ~
~ ,Fe2+被完全氧化,Br-被部分氧化,故C错误;
,Fe2+被完全氧化,Br-被部分氧化,故C错误; ,只氧化Fe2+,故D正确;
,只氧化Fe2+,故D正确;

 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
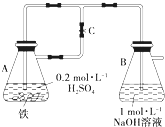 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源:长宁区一模 题型:多选题
| A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl- |
| B.x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl- |
| C.x=0.6,2Br-+Cl2→Br2+2Cl- |
| D.x=0.4,2Fe2++Cl2→2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com