
| A.将氢氧化钠固体放在滤纸上称量 |
| B.用10mL量筒量取8.58mL蒸馏水 |
| C.制取氯气时,用二氧化锰民浓盐酸在常温下反应,并用向下排空气法收集 |
| D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
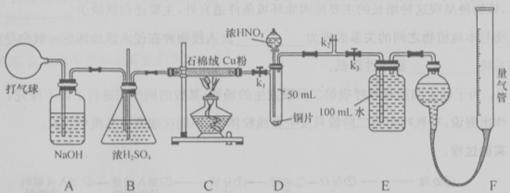
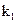 、
、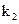 ,打开
,打开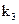 ,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入
,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入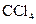 至满。则D中一定发生反应的离子方程式为:_________;
至满。则D中一定发生反应的离子方程式为:_________;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.950ml;201.4g | B.1000ml; 212g | C.100ml; 21.2g | D.500ml; 100.7g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。 结论:该溶液中有SO42- |
| B.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。 结论:该溶液中有NH4+ |
| C.向1 mL浓度均为0.05mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1 的AgNO3溶液,振荡,沉淀呈黄色。结论: Ksp(AgCl)>Ksp(AgI) |
| D.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.湿润的硝酸铅试纸遇H2S 变黑 | B.Cu与浓H2SO4反应 |
| C.Fe粉和FeCl3溶液反应 | D.往酸性高锰酸钾溶液中滴入少 量Fe2(SO4)3稀溶液 量Fe2(SO4)3稀溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶 液,若无沉淀,说明Ba2+已经完全沉淀 |
| B.淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有红色沉淀生成,说明淀粉已经完全水解 |
| C.将Na2SO4·10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 |
| D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,说明已达滴定终点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液漏斗 | B.胶头滴管 | C.烧杯 | D.500mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称取25.20 g氯化钠 |
| B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com