(2013?临沂二模)铝元素在自然界中主要存在于铝土矿(主要成分为Al
2O
3,还含有Fe
2O
3、FeO、SiO
2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下.
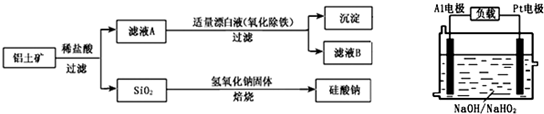
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe
2++□ClO
-+
5H2O
5H2O
═□Fe(OH)
3↓+□C1
-+
4H+
4H+
.
②检验滤液B中是否还含有铁元素的方法为:
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
(注明试剂、现象).
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
c
c
(填代号).
A.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
过滤
过滤
(填操作名称)、洗涤.
(2)已知H
2O
2是一种弱酸,在强碱性溶液中主要以HO
2-形式存在.目前研究比较热门的Al-H
2O
2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO
2-═2AlO
2-+OH
-+H
2O
①正极反应式为
HO2-+2e-+H2O=3OH-
HO2-+2e-+H2O=3OH-
.
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl
4-形式存在).不采用氯化铝溶液的原因是
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
.
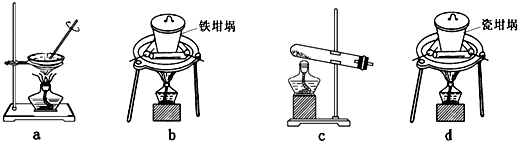
(4)SiO
2和NaOH焙烧制备硅酸钠,可采用的装置为
b
b
(填代号).





 应用题作业本系列答案
应用题作业本系列答案