
下列说法中正确的是
A.化学的主要目的就是制备出大量的人工合成元素
B.向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C.为了增加食物的营养成分、保质期,可以在安全、合理的范围内使用食品添加剂
D.从自然界中提取元素的单质都必须通过化学反应才能实现
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2014-2015山东省聊城市茌平等三县高二上学期期末联考化学试卷(解析版) 题型:选择题
最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A.水的离子积仅适用于纯水
B.水的电离和电解都需要电
C.升高温度一定使水的离子积增大
D.加入电解质一定会破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
对于4℃时100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液,下列说法中正确的是:
A.该溶液物质的量浓度为10moL/L
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b。下列a与b的组合中,不可能形成喷泉的是

A.NO2和H2O
B.SO2和NaOH溶液
C.NH3和H2O
D.CH4、Cl2混合气和饱和食盐水
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:填空题
(14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g)2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是___________________________________;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________;

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=﹣483.5kJ/mol 、N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_________________________;
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
今有室温下四种溶液,有关叙述不正确的是
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加入水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)=c(NH)>c(OH-)=c(H+)
D.Va L④与Vb L②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
现在四种晶体,其离子排列方式如图所示,其中化学式正确的是
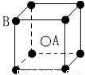



A.AB2 B.EF2 C.XY3Z D.AB3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
(14分)过氧化钙(CaO2)是一种白色粉末,微溶于水。加热至350°C左右开始分解,与水或酸能反应生成H2O2。应用于处理含重金属离子的废水,治理赤潮。其制备过程如下图所示

请回答下面的问题:
(1)CaO2的电子式___________
(2)制取CaO2·8H2O的原理是(用化学反应方程式表达): ,其中H2O2体现 性质。
(3)沉淀过程中加氨水的作用________________________________
(4)沉淀反应需用冰水浴控制温度,原因是_____________(写出两种)
(5)CaO2受热分解的化学方程式: 。
(6)CaO2质量百分百含量的测定:称取0.8000g样品用硫酸溶解,再用0.1000mol/L的KMnO4溶液滴定,消耗40.00 mLKMnO4溶液,则CaO2的含量为_________
(7)CaO2可以使废水中的Mn2+变成MnO2沉淀而除去,用离子方程式表达其原理 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com