
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
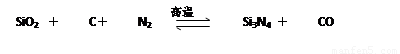
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)反应中每产生6.72 L(标准状况)CO气体,破坏 π 键的数目为 ;
(3)Si 价电子排布式为 ;
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4 中氢的化合价为 ,Si3N4所属的化合物类型是 (填“离子化合物”或“共价化合物”)。
(1)3 6 2 1 6 (2)0.2NA (3) 3s23p2 (4)-1 共价化合物
【解析】
试题分析:(1)由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量
数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2 Si3N4+6CO。(2)6.72 LCO的物质的量是6.72L/(22.4L/mol)=0.3mol,故破坏 π 键的数目为0.2NA 。(3)Si 价电子排布式为 3s23p2
。(4)电负性数值小的元素在化合物吸引电子的能力弱,元素的化合价为正值;电负性大的元素在化合物中吸引电子的能力强,元素的化合价为负值。通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。故SiH4 中氢的化合价为-1价,Si3N4为共价化合物。
Si3N4+6CO。(2)6.72 LCO的物质的量是6.72L/(22.4L/mol)=0.3mol,故破坏 π 键的数目为0.2NA 。(3)Si 价电子排布式为 3s23p2
。(4)电负性数值小的元素在化合物吸引电子的能力弱,元素的化合价为正值;电负性大的元素在化合物中吸引电子的能力强,元素的化合价为负值。通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。故SiH4 中氢的化合价为-1价,Si3N4为共价化合物。
考点:化学反应方程式配平,电负性,原子核外电子排布,共价键。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、氮化硅陶瓷可用于制造汽车发动机 |
| B、氮化硅中氮元素的化合价为─3 |
| C、氮化硅陶瓷属于新型无机非金属材料 |
| D、氮化硅不会与任何酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N2)/mol | 2.00 | 1.40 | 1.12 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com