
如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是

A.三种元素中,Z元素原子半径最小
B.X、Y 两种元素的气态氢化物能相互反应
C.Z位于元素周期表中第2周期、第ⅥA族
D.Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
下列关于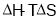 说法中正确的是( )
说法中正确的是( )
A.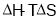 可用于判断所有条件下的反应能否自发进行
可用于判断所有条件下的反应能否自发进行
B.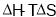 只用于判断温度、体积一定的反应能否自发进行
只用于判断温度、体积一定的反应能否自发进行
C.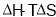 只用于判断温度、压强一定的反应能否自发进行
只用于判断温度、压强一定的反应能否自发进行
D.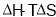 <0的反应,在该条件下一定剧烈反应
<0的反应,在该条件下一定剧烈反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
在Al2(SO4)3、K2SO4和明矾的混合溶液中,如果c(SO42-)等于0.2 mol/L,当加入等体积的0.2 mol/L 的KOH溶液时,生成的沉淀恰好溶解,则原混合溶液中K+的物质的量浓度为
A.0.2 mol/L B.0.25 mol/L C.0.45 mol/L D.0.225 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①非金属置换金属的反应
②弱酸反应可以生成强酸
③有单质参加的非氧化还原反应
④没有水生成,也没有沉淀和气体生成的复分解反应
A.②④ B.①③④ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: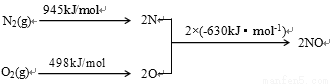
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
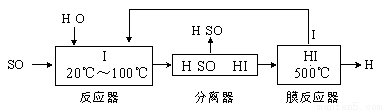
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_____________________。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:推断题
(12分)甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
短周期主族元素A,B,C,D,E的原子序数依次增大,其中只有C为金属元素,B是地壳中含量最多的元素,C原子的最外层电子数和A相等;C,D两元素原子的质子数之和是A,B两元素质子数之和的3倍,下列叙述正确的是
A.元素的原子半径:A<B<C<D<E
B.对应氢化物的热稳定性:D>E
C.B与C、B与D形成的化合物中化学键类型相同
D.5种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的电离方程式不正确的是
A.NaHCO3===Na++H++
B.
C.AlCl3===Al3++3Cl-
D.NaHSO4===Na++H++
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com