Ⅰ.现有标准状况下的以下物质:
A.11.2LO2 B.6.8gNH3 C.1.204×1024CH4 D.0.5molCO2;
其中质量由大到小的顺序为 ,各物质所含原子数由大到小的顺序是 ,其体积由大到小的顺序是 ,气体的密度由大到小的顺序是 .(填序号)
Ⅱ.相同质量的CO和CO2,其物质的量之比为 ,所含的氧原子个数比为 ,所含碳元素的质量比为 ,相同条件下的体积比为 .
【答案】
分析:根据n=
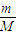
=
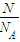
=
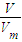
结合分子的构成和物质的组成来计算.
解答:解:Ⅰ由n=
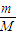
=
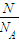
=
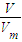
可知:
A.11.2LO
2的n(O
2)=
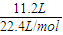
=0.5mol,m(O
2)=0.5mol×32g/mol=16g,原子数为2×0.5N
A=1N
A,ρ=
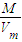
=
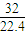
g/L;
B.6.8gNH
3的n(NH
3)=
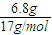
=0.4mol,原子数为4×0.4N
A=1.6N
A,ρ=
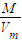
=
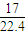
g/L;
C.1.204×10
24CH
4的n(CH
4)=
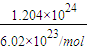
=2mol,m(CH
4)=2mol×16g/mol=32g,ρ=
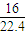
g/L;
D.0.5molCO
2的m(CO
2)=0.5mol×44g/mol=22g,原子数为3×0.5N
A=1.5N
A,ρ=
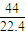
g/L;
所以:质量由大到小的顺序为C>D>A>B,各物质所含原子数由大到小的顺序是C>B>D>A,其体积由大到小的顺序是C>A=D>B,气体的密度由大到小的顺序是D>A>B>C,
故答案为:C>D>A>B;C>B>D>A;C>A=D>B;D>A>B>C;
Ⅱ设CO和CO
2的质量都为mg,则n(CO)=
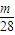
mol,n(CO
2)=
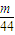
mol,
则:物质的量之比为:
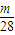
mol:
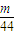
mol=11:7,
所含的氧原子个数比为:11:7×2=11:14,
所含碳元素的质量比等于碳元素的物质的量之比,为:11:7,
相同条件下的体积比为等于物质的量之比,为11:7.
故答案为:11:7;11:14;11:7;11:7.
点评:本题考查物质的量的相关计算,题目难度不大,注意计算公式的运用,加强对概念的理解.

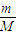 =
=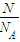 =
=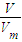 结合分子的构成和物质的组成来计算.
结合分子的构成和物质的组成来计算.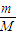 =
=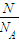 =
=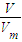 可知:
可知: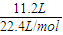 =0.5mol,m(O2)=0.5mol×32g/mol=16g,原子数为2×0.5NA=1NA,ρ=
=0.5mol,m(O2)=0.5mol×32g/mol=16g,原子数为2×0.5NA=1NA,ρ=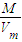 =
=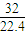 g/L;
g/L;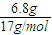 =0.4mol,原子数为4×0.4NA=1.6NA,ρ=
=0.4mol,原子数为4×0.4NA=1.6NA,ρ=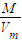 =
=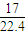 g/L;
g/L;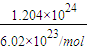 =2mol,m(CH4)=2mol×16g/mol=32g,ρ=
=2mol,m(CH4)=2mol×16g/mol=32g,ρ=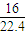 g/L;
g/L;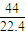 g/L;
g/L;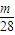 mol,n(CO2)=
mol,n(CO2)=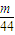 mol,
mol,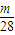 mol:
mol: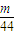 mol=11:7,
mol=11:7,
