

 (图中球与球之间的连线代表化学键,如单键、双键).则A的结构简式为
(图中球与球之间的连线代表化学键,如单键、双键).则A的结构简式为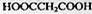 与产物
与产物 的差异可确定A中含有一个苯环,且苯环上有一羟基,结合题给的A的分子结构模型可知A的结构简式为
的差异可确定A中含有一个苯环,且苯环上有一羟基,结合题给的A的分子结构模型可知A的结构简式为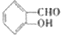 ;B通过信息反应生成C,则C为
;B通过信息反应生成C,则C为 ;C发生酯化反应生成D香豆素内酯(C9H6O2),其分子结构中除含有一个苯环外,还有六元环,则D的结构简式为:
;C发生酯化反应生成D香豆素内酯(C9H6O2),其分子结构中除含有一个苯环外,还有六元环,则D的结构简式为: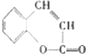 ,据此进行解答.
,据此进行解答.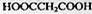 与产物
与产物 的差异可确定A中含有一个苯环,且苯环上有一羟基,结合题给的A的分子结构模型可知A的结构简式为
的差异可确定A中含有一个苯环,且苯环上有一羟基,结合题给的A的分子结构模型可知A的结构简式为 ;B通过信息反应生成C,则C为:
;B通过信息反应生成C,则C为: ;C发生酯化反应生成D香豆素内酯(C9H6O2),其分子结构中除含有一个苯环外,还有六元环,则D的结构简式为:
;C发生酯化反应生成D香豆素内酯(C9H6O2),其分子结构中除含有一个苯环外,还有六元环,则D的结构简式为: ,
, ,故答案为:
,故答案为: ;
; ,
, ;
; ,C与足量NaOH溶液反应的化学方程式为:
,C与足量NaOH溶液反应的化学方程式为: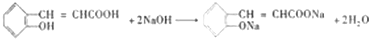 ,
,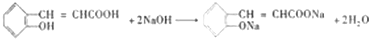 ;
; ,A分子结构中羟基与醛基处于相邻碳原子上,当羟基与醛基分别位于间位和对位碳时存在同分异构体为:
,A分子结构中羟基与醛基处于相邻碳原子上,当羟基与醛基分别位于间位和对位碳时存在同分异构体为: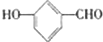
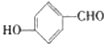 ,另外
,另外 和
和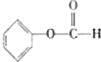 也是A的同分异构体,
也是A的同分异构体, ;
; ;
; ;
; ;
;| bg |
| 18g/mol |
| b |
| 18 |
| b |
| 18 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为2H2O+O2+4e-=4OH- |
| B、CO32-向负极移动 |
| C、电子由正极经外电路流向负极 |
| D、电池中CO32-的物质的量将逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、②③④ | C、③④ | D、①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com