
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的△H<0
D. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
【答案】D
【解析】A、铅蓄电池电极反应:负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O 不难看出铅蓄电池在放电过程中,负极生成PbSO4质量增加,正极生成PbSO4质量也增加,选项A错误;B、二氧化硫通入硝酸钡溶液中,酸性条件下,硝酸根具有强氧化性,将亚硫酸氧化为硫酸,进一步反应得到硫酸钡,故SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO4,选项B错误;C、依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析,反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,△H-T△S>0,反应的熵变△S>0,则△H>0,选项C错误;D、逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJmol-1,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
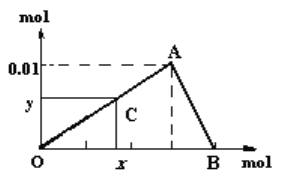
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是:______________________________;由此可得A点的坐标为_______;此时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________________,由此可得B点的坐标为:_________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镭是周期表中第7周期第ⅡA主族元素,下列关于镭的性质描述中不正确的是
A. 在化合物中呈+2价 B. 镭比钙的金属性强
C. 氢氧化物呈两性 D. 碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)氯吡苯脲是一种西瓜膨大剂(植物生长调节剂),其组成结构和物理性质见下表。
分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
C12H10ClN3O |
| 白色结晶粉末 | 170~172 ℃ | 易溶于水 |
查文献可知,可用2-氯-4-氨吡啶与异氰酸苯酯反应,生成氯吡苯脲。
![]()
反应过程中,每生成1 mol氯吡苯脲,断裂____个σ键、断裂____个π键。
(2)过渡金属离子与水分子形成的配合物是否有颜色与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如Co(H2O)6]2+显粉红色。据此判断:Mn(H2O)6]2+_____(填“无”或“有”)颜色。
(3)硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成B(OH)4]-而体现一元弱酸的性质,则B(OH)4]-中B的原子杂化类型为_________;
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:___________________________________。
(5)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为____________;其中四核阳离子的立体构型为____________,其中心原子的杂化轨道类型是____________。
②分子中的大π键可用符号表示πmn,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为π66。则N5-中的大π键应表示为____________。
③请表示出上图中的氢键:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
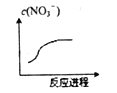
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列联系实际的说法正确的是( )
A. 高梁、玉米等植物的种子经发酵、蒸馏得到的“绿色能源”是甲烷
B. 人类目前直接利用的能量大部分是由化学反应产生的
C. 煤、石油、天然气都是可再生能源
D. 硫和碳的氧化物是形成酸雨的主要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( ![]() )、苯甲酸(
)、苯甲酸( ![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点 (0C) | 沸点 (0C) | 相对密度 ( | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
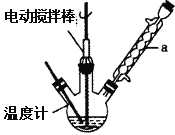
(1)装置a的名称是__________________,主要作用是____________________。
(2)三颈瓶中发生反应的化学方程式为______________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是______________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。【苯甲酸相对分子质量:122.0】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com