
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
(14分)(1)强氧化性(1分) Cl2+2OH-=ClO-+Cl-+H2O(2分)
(2)2 2 H2O 2 2 1(水分子1分,系数1分,共2分)
(3)①2ClO-+SO2=2ClO2+SO42-(2分) ②1.6mol(2分) ③2:5(2分)
(4)32(2分) 强(1分)
【解析】
试题分析:(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性。氯气能被氢氧化钠溶液吸收,所以工业上用氯气和NaOH溶液生产消毒剂NaClO,有关反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O。
(2)根据物质的化学式可知,反应前后元素化合价发生变化的是氯元素。其中部分氯元素的化合价从0价升高到+1价,部分降低到-1价,所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是2:1.根据原子守恒可知,反应前还有水参加,所以配平后的方程式是2 Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O.
(3)①KClO3与SO2在强酸性溶液中反应可制得ClO2,在反应中SO2被氧化生成硫酸钾,所以此反应的离子方程式为2ClO-+SO2=2ClO2+SO42-。
②ClO2遇浓盐酸会生成Cl2,则该反应的化学方程式是2ClO2+8HCl(浓)=4H2O+5Cl2↑。根据方程式可知反应中转移电子的个数是8个,所以每生成1mol Cl2转移电子的物质的量为8mol÷5=1.6mol。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-。在反应中氯元素的化合价从+4价降低到-1价,得到5个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,所以根据电子的得失守恒可知,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(4)设断开1 mol H-O键与断开1 mol H-Cl键所需能量分别是x与y,由于反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据题意可知4y+498kJ-2×243 kJ-4x=-115.6 kJ,解得x-y=32 kJ,因此H2O中H—O键比HC1中H—Cl键强。
考点:考查氧化还原反应的判断、计算、方程式的配平以及反应热的计算等


科目:高中化学 来源: 题型:阅读理解
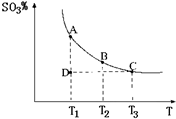 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 2SO3(g)是
2SO3(g)是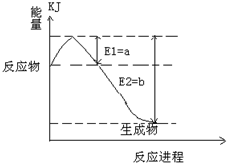
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com