
【题目】某地海水中主要离子的含量如表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
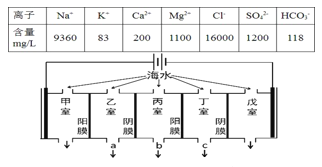
A.甲室的电极反应式为:2Cl--2e-=Cl2↑
B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为b
D.通过甲室阳膜的离子的物质的量为2mol时,戊室收集到22.4L(标准状况下)气体
【答案】D
【解析】
A. Cl放电能力大于OH,所以阳极的电极反应式为2Cl2e=Cl2↑,A项正确;
B. 开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH,生成的OH和HCO3反应生成CO32,Ca2+转化为CaCO3沉淀,所以电解一段时间后阴极区会发生反应:Ca2++OH+HCO3=CaCO3↓+H2O,B项正确;
C. 阴(阳)离子交换膜只允许阴(阳)离子通过,所以电解时丙室中阴离子移向乙室,阳离子移向丁室,所以乙室和丁室中部分离子的浓度增大,丙室中物质主要是水,淡水的出口应为b,C项正确;
D. 通过甲室阳膜的阳离子有Na+、K+、Ca2+、Mg2+等,当通过甲室阳膜的离子的物质的量为2mol时,转移电子在2-4mol之间,戊室收集到22.4L即1molH2,转移电子2mol,不守恒,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是__。
SO2压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2molSO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
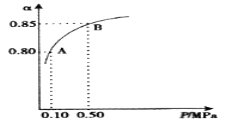
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”、“<”或“=”),B点的化学平衡常数是__。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①tl时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是__。
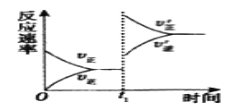
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20molSO2和0.10molO2,则平衡__移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,_mol<n(SO3)<_mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中由水电离出的c(H+)=1×10-11mol/L,该溶液不可能是( )
A. 硫酸氢钠溶液 B. 醋酸钠溶液 C. 氢氧化钠溶液 D. 二氧化硫水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 可以写成
可以写成![]() 。有机物A的结构如下图所示,请回答:
。有机物A的结构如下图所示,请回答:

(1)有机物A分子所含官能团的名称为__________________。
(2)1mol A最多与____mol H2在一定条件下反应可生成环烃B。
(3)有机物A的分子式为_____________________________。
(4)有机物C是A的同分异构体,属于芳香烃,且C在一定条件下可发生聚合反应,生成高分子化合物D。则C的结构简式为______________,D的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和____。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
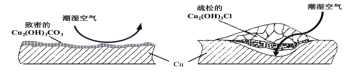
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因____。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:
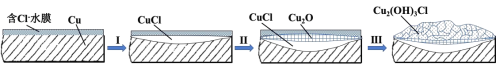
①过程Ⅰ的正极反应物是____。
②过程Ⅰ负极的电极反应式是____。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:请回答下列问题:
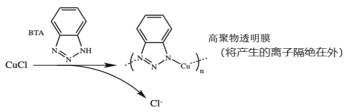
①写出碳酸钠法的离子方程式____。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有____。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
D.原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在医药工业中,有机物 G是一种合成药物的中间体 ,其合成路线如图所示 :
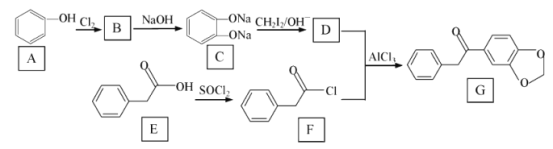
已知:R1ONa+R2X→R1OR2+NaX(R1与 R2代表苯环或烃基、X 代表卤素原子)
RCOOH+SOCl2(液体)→RCOCl+HCl↑+SO2↑
回答下列问题:
(1)A 与C在水中溶解度更大的是 _________ , G 中官能团的名称是 ___________。
(2)E→F 的有机反应类型是 ________ ,F 的分子式为______________。
(3)由A→B反应的化学方程式为 ___________________。
(4)物质D的结构简式为 _________________。
(5)B→C 反应中加入NaOH 的作用是________________。
(6)写出一种符合下列条件的G的同分异构体 _________________ 。
①与G的苯环数相同;②核磁共振氢谱有5 个峰;③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
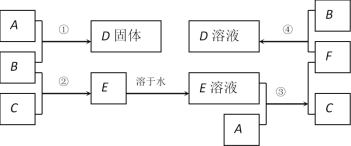
请回答:
(1)写出A、B、C的化学式。A:___________________ B:___________________ C:____________________
(2)反应①的化学方程式为:________________________________________________
(3)反应③的化学方程式为:________________________________________________
(4)反应④的离子方程式为:________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇俗称酒精,75%的酒精能用来杀菌消毒。下列说法中正确的是( )
A.乙醇的球棍模型: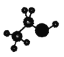
B.酒精的杀菌消毒原理是让蛋白质变性,且浓度越大消毒效果越好
C.酒精可以通过大量喷洒来消毒,也可以和84消毒液混合使用消毒
D.95%的酒精和蒸馏水以体积比75:20混合可配制75%的酒精(忽略体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com