
 CuO
CuO CuSO4
CuSO4  CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2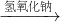 Cu(OH)2
Cu(OH)2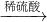 CuSO4
CuSO4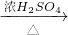 CuSO4
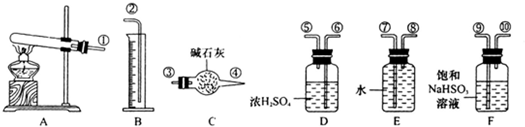
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示: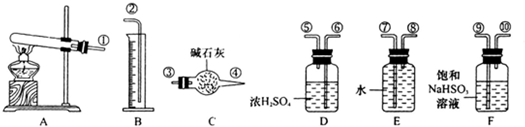
 =0.0375mol,根据三氧化硫和亚硫酸氢钠之间的关系式知,三氧化硫和亚硫酸氢钠反应生成的二氧化硫和三氧化硫的物质的量相等,所以三氧化硫和原生成的二氧化硫的物质的量之和是0.0375mol;测得量筒B中水的体积,得出气体在标准状况下的体积为280mL,该气体是氧气,其物质的量是
=0.0375mol,根据三氧化硫和亚硫酸氢钠之间的关系式知,三氧化硫和亚硫酸氢钠反应生成的二氧化硫和三氧化硫的物质的量相等,所以三氧化硫和原生成的二氧化硫的物质的量之和是0.0375mol;测得量筒B中水的体积,得出气体在标准状况下的体积为280mL,该气体是氧气,其物质的量是 =0.0125mol,根据氧化还原反应中得失电子数相等知,原生成的二氧化硫的物质的量=
=0.0125mol,根据氧化还原反应中得失电子数相等知,原生成的二氧化硫的物质的量=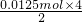 =0.025mol,所以生成的三氧化硫的物质的量是0.0375mol-0.025mol=0.0125mol;6g无水CuSO4的物质的量=
=0.025mol,所以生成的三氧化硫的物质的量是0.0375mol-0.025mol=0.0125mol;6g无水CuSO4的物质的量= =0.0375mol,根据铜原子守恒知,生成氧化铜的物质的量是0.0375mol,所以n(CuSO4):n(CuO):n(SO2):n(SO3):n(O2)=0.0375mol:0.0375mol:0.025mol:0.0125mol:0.0125mol=3:3:2:1:1,所以其分解方程式为3CuSO4
=0.0375mol,根据铜原子守恒知,生成氧化铜的物质的量是0.0375mol,所以n(CuSO4):n(CuO):n(SO2):n(SO3):n(O2)=0.0375mol:0.0375mol:0.025mol:0.0125mol:0.0125mol=3:3:2:1:1,所以其分解方程式为3CuSO4 3CuO+2SO2↑+SO3↑+O2↑,
3CuO+2SO2↑+SO3↑+O2↑, 3CuO+2SO2↑+SO3↑+O2↑.
3CuO+2SO2↑+SO3↑+O2↑.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:阅读理解
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
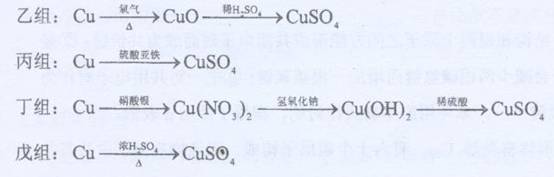
(1)甲组实验可用一个化学反应方程式表示为 ,使反应变快的可能原因是 。
(2)在五个方案中,科学性有错的是 组方案,经济性最差的是 组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用 组方案;②无污染,这应排除 组方案。
(4)相对能耗低,污染小的是 组方案。该给从反应器中排出的溶液中(含有少量H2SO??4??以抑制水解)取得产品的实验操作步骤应为 、 、 ,对取得产品后残留物质的处理方法是 。
查看答案和解析>>
科目:高中化学 来源:云南省同步题 题型:实验题

 ,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示
,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示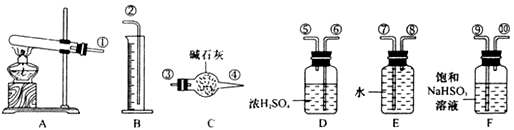
查看答案和解析>>
科目:高中化学 来源:2009年山东省滨州市高考化学模拟试卷(解析版) 题型:解答题
 CuO
CuO CuSO4
CuSO4 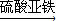 CuSO4
CuSO4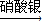 Cu(NO3)2
Cu(NO3)2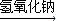 Cu(OH)2
Cu(OH)2 CuSO4
CuSO4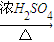 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示: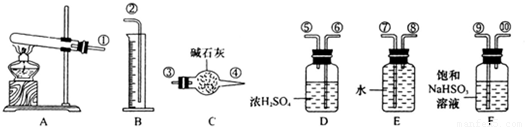
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com