

 ,据此解答.
,据此解答. ,
,| 催化剂 |
| Cu |
| △ |
| 浓硫酸 |
| △ |
 ,
,| 催化剂 |
| Cu |
| △ |
| 浓硫酸 |
| △ |
 ,加聚反应.
,加聚反应.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、实验中,乙烯的用量不会影响该反应的反应焓变△H |
| B、0.5molH2O(l)完全反应放出的热量为22.9kJ |
| C、1molC2H5OH(g)具有的能量大于1molC2H4(g)和1molH2O(g)所具有的能量和 |
| D、1molC2H4(g)和1molH2O (g)中化学键的总键能大于1molC2H5OH(g)中化学键的总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
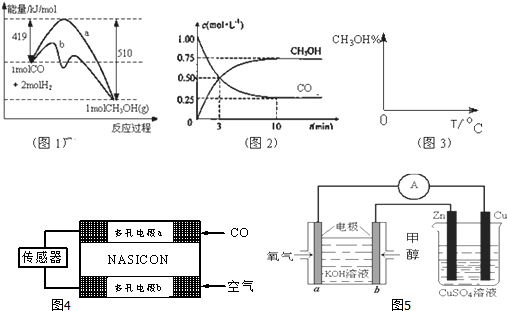
查看答案和解析>>
科目:高中化学 来源: 题型:
 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).
 )经过几步有机反应制得,其中最佳的次序是:
)经过几步有机反应制得,其中最佳的次序是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其它条件不变,增大压强,平衡不发生移动 | ||||
| B、其它条件不变,增大压强,混合气体的总质量不变 | ||||
C、反应可以从正反应开始,也可以从逆反应开始,但必须满足下列条件:其中x、y、z分别表示第一次达到平衡时,A、B、D的物质的量(mol),(其中M表示物质的摩尔质量,下同)
| ||||
D、反应只能从正反应开始,且原混合气中A与B的物质的量之比为2:1,并有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
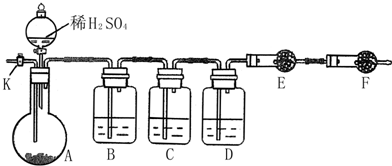 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com