
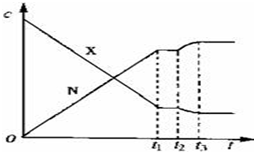
| A. | 降低温度 | B. | 增大N的浓度 | C. | 减小X的浓度 | D. | 增大压强 |
分析 由图可知,t2 s~t3 s之间,N的浓度增大,X的浓度减小,该反应为放热反应,则降到温度或增大Y的浓度,使平衡正向移动,与图象符合,以此来解答.
解答 解:A.该反应为放热反应,降低温度,平衡正向移动,N的浓度增大,X的浓度减小,与图象一致,故A选;
B.增大N的浓度,平衡逆向移动,X的浓度增大,故B不选;
C.减小X的浓度,平衡逆向移动,N的浓度减小,故C不选;
D.该反应为气体体积不变的反应,增大压强,平衡不移动,且反应体系中各物质浓度均增大,故D不选;
故选A.
点评 本题考查图象及化学平衡移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象分析及反应特点,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
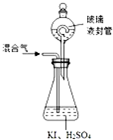 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题: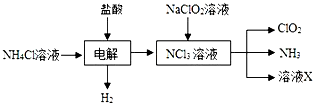
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
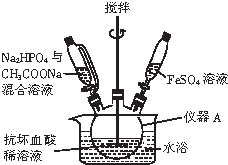 磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:
磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铷比镁金属性强 | |
| B. | 氯化镁比氯化铷难溶 | |
| C. | 高温下,镁离子得电子能力比铷离子弱 | |
| D. | 铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{{c(N{H_3}•{H_2}O)•c({H^+})}}{{c(N{H_4}^+)}}$增大 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
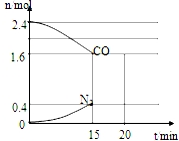 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
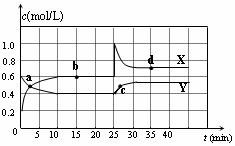
| A. | 图中的两条曲线,X表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)=0.02 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L | |
| D. | 该温度下反应的平衡常数 K=1.11 L/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com