
我国有较长的海岸线,海洋资源十分丰富。利用海水资源可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
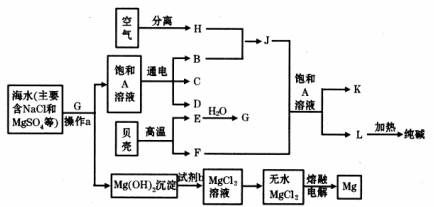
(1)从海水中提取镁的步骤中,试剂b可以选用上图中的 发生反应制取得到(以字母表示)。
(2)分离出Mg(OH)2后的溶液中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得纯净的溶液A,在分离后的溶液中应依次加人过量的BaCl2溶液、Na2CO3溶液并过滤,再向滤液中加入适量盐酸。实验中加人过量BaCl2溶液是为了除去 离子;加入过量Na2CO3溶液发生反应的离子方程式是 。
(3)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 。
(4)电解A溶液时阳极反应的电极反应式为 ,当阴极产生标准状况下的气体1.12L时,整个过程中转移的电子总数为 (阿伏加德罗常数用NA表示)。
(5)将F和J通入A的饱和溶液中,反应的化学方程式为 。
(6)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
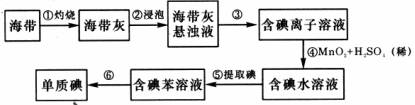
步骤⑤所选用主要仪器是 ,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:0107 模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。
(1)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
Ⅰ、空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_________________(写出离子方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③_________________(写出离子方程式)。
其中反应②中氧化剂是_________,还原剂是___________
Ⅱ、空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式 ____________________ 。
Ⅲ、溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的实验仪器名称是 ___________________。
下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
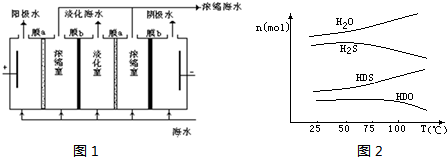
 (2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
(2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个
反应中涉及的四种物质在反应体系中的物质的量随温
度的变化曲线。写出100℃时所发生的反应的化学方
程式________________________________________;
工业上富集HDO的生产过程中,可以循环利用的一种
物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。
(1)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
Ⅰ、空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_________________(写出离子方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③_________________(写出离子方程式)。
其中反应②中氧化剂是_________,还原剂是___________
Ⅱ、空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式 ____________________ 。
Ⅲ、溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的实验仪器名称是 _________________。
下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
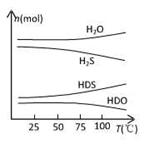
(2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100℃时所发生的反应的化学方程式________________________________________;工业上富集HDO的生产过程中,可以循环利用的一种物质是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com