
| A. | 只有在生物体内才能合成的物质 | B. | 有机物都是含有碳元素的化合物 | ||
| C. | 有机化合物都能燃烧 | D. | 含有碳元素的物质 |
分析 含有碳元素的化合物,或碳氢化合物及其衍生物总称为有机化合物,简称有机物.无机物是无机化合物的简称,通常指不含碳元素的化合物.少数含碳的化合物,如一氧化碳、二氧化碳、碳酸盐、氰化物等也属于无机物.
解答 解:A.含有碳元素的化合物是有机物,有机物可人工合成,如尿素,故A错误;
B.含有碳元素的化合物,或碳氢化合物及其衍生物总称为有机化合物,简称有机物,故B正确.
C.有机化合物不一定能燃烧,如四氯化碳可用来灭火,故C错误;
D.含碳元素的物质不一定是有机物,如一氧化碳、二氧化碳、碳酸盐属于无机物,故D错误;故选B.
点评 本题主要考查有机化合物定义,难度不大,平时注意知识的积累,注意有机物与无机物的区别.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
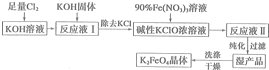

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
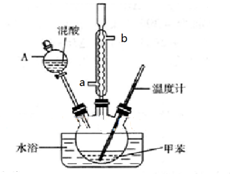
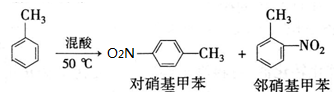
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
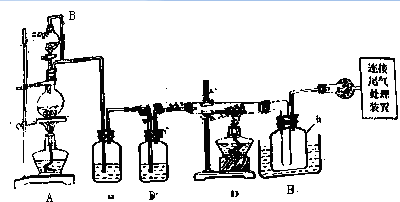
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子总数 | B. | 质量 | C. | 密度 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 硫酸氢钠与氢氧化钠溶液的反应:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com