
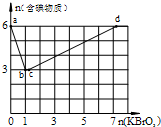
 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
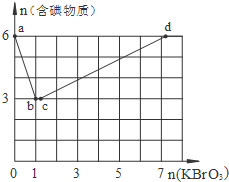 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
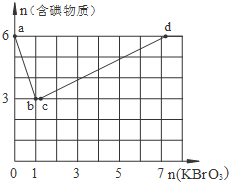 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

 2HI(g),实验测得起始及平衡时的有关数据如表所示:
2HI(g),实验测得起始及平衡时的有关数据如表所示: 
 2HI(g) △H=-23.15kJ/mol
2HI(g) △H=-23.15kJ/mol 查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省重点中学高三(上)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com