
下表中所列的字母分别代表某一化学元素。完成下列填空:
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | b | | |
| c | | | | | | | | | | | | d | | | e | f | |
| | | | | | | | | | | | | | g | | | | |
| | | | | | | | | | | | | | | | h | | |
| | i | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(本题共8分)(1)6(1分),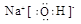 (1分);
(1分);
(2)2Al+2OH—+2H2O→2AlO2—+3H2↑(2分);
(3)Cl(1分),ad(2分);
(4)第四周期VA族(1分)
解析试题分析:(1)根据元素在周期表中的相对位置可知,h是第五周期第ⅥA族的Te,根据构造原理可知其核外电子排布式是1s22s22p63s23p63d104s24p64d105s25p4,所以h的最外层有6种运动状态的电子。a、b、c三种元素分别是H、O、Na,三种元素形成的化合物是氢氧化钠,氢氧化钠是离子化合物,其电子式为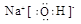 。
。
(2)d是铝,i是Ba,氢氧化钡是强碱能溶解金属铝,反应的离子方程式是2Al+2OH—+2H2O→2AlO2—+3H2↑。
(3)元素e与f元素分别是S和Cl,同周期自左向右非金属性逐渐增强,所以氯元素的非金属性强于硫元素的非金属性。a.非金属性越强,相应阴离子的还原性越弱,所以根据e的阴离子还原性强于f的阴离子可以说明氯元素的非金属性强于硫元素的,a正确;b.氢化物的酸性强弱与非金属性强弱无关系,因此f的氢化物酸性强于e的氢化物不能说明氯元素的非金属性强于硫元素的,b不正确;c. 非金属单质的熔点与非金属性强弱无关系,则根据e单质的熔点高于f单质 不能说明氯元素的非金属性强于硫元素的,c不正确;d.非金属性越强,越容易得到电子,因此根据e和f形成的化合物中,e显正价,f显负价可以说明氯元素的非金属性强于硫元素的,d正确,答案选ad。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以所在周期原子半径最大的非金属元素,其气态氢化物为三角锥形极性分子的元素应该是第四正确第ⅤA族的As元素。
考点:考查元素周期表的结构、元素周期律以及核外电子排布、电子式和方程式书写等


科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。
①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2;
②每2molX2可与1molY2化合生成2molX2Y,X2Y在常温下为液体;
③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色;
④Z单质溶于化合物X2Y,所得溶液具有漂白作用;请回答:
(1)画出Z原子的原子结构示意图 ;实验室中的W应保存在____________中(填试剂名称)
(2)写出化学式W2Y2___________ _K#S5U
(3)写出与W+具有相同核外电子数的分子或原子,请写出任意3种的化学式
① ② ③
(4)Z单质与水反应的离子方程式:_________________________
⑸W单质与X2Y化学反应方程式:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是 。
(2)比较元素B和C的第一电离能:B C(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为 ,盐Y的晶体类型是 。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为 。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量:
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了A~G7种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | C | D | E | | |
| 3 | | | B | | | | F | G |
| 4 | A | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的 周期 族,原子结构示意图为 。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),BE4分子的空间构型是 。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为 。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回答以下关于第三周期元素及其化合物的问题。
(1)Na原子核外共有 种不同运动状态的电子,有 种不同能量的电子。
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。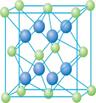
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是四种有机物,它们的分子中含有两个碳原子,其中A和B是烃。在标准状况下,A对氢气的相对密度是13,B与HCl反应生成C,C与D混合后加入NaOH并加热,可生成B。
(1)写出A、B、C、D的结构简式。A、 B、 C、 D、
(2)写出有关化学方程式: 、
。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。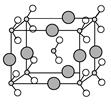
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com