
分析 利用M=$\frac{m}{n}$求出混合气体的平均摩尔质量,根据十字交叉法计算各组分的物质的量之比,由此计算其质量分数和体积分数.
解答 解:标准状况下7L气体的物质的量为:$\frac{7L}{22.4L/mol}$=$\frac{1}{3.2}$mol,
混合气体的平均摩尔质量为:$\frac{2.25g}{\frac{1}{3.2}mol}$=7.2g/mol,
利用十字交叉法计算各组分的物质的量之比: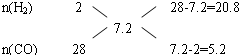
即$\frac{n({H}_{2})}{n(CO)}$=$\frac{20.8}{5.2}$=$\frac{4}{1}$,
H2的质量分数量分数为:ω(H2)=$\frac{2g/mol×4mol}{2g/mol×4mol+28g/mol×1mol}$×100%=22.2%;
CO的质量分数量分数为:ω(CO)=1-ω(H2)=1-22.2%=77.8%;
体积之比等于物质的量之比,则:
H2的体积分数为φ(H2)=$\frac{4mol}{4mol+1mol}$×100%=80%;
CO的体积分数为φ(CO)=1-φ(H2)=1-80%=20%,
答:质量分数:H2 22.2%,CO 77.8%,体积分数:H2 80%,CO 20%.
点评 本题考查了物质的量的有关计算,题目难度不大,注意十字交叉法是解题的一种简便方法,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-483.6 kJ•mol-1,则氢气的燃烧热为483.6 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向密闭容器中再充入N2,则反应速率减慢 | |
| B. | 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol•L-1•s-1 | |
| C. | 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态 | |
| D. | 若某时刻消耗了1molN2同时生成了2molNH3,则表明该反应达到了平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比V(A):V(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hg、Pb、C、Na | B. | Cu、K、S、P | C. | Hg、Pb、Mn、Ni | D. | Br、N、Pb、As |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
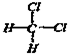 和
和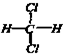
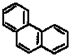 和
和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com