
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A.生石灰—Ca(OH)2B.石灰石—CaCO3
C.烧碱—Na2CO3D.苏打—NaHCO3
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用滴定管量取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为cmol/L的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是____________________→D→______(均用字母填写)。
(2)读取盛装cmol/L标准硫酸溶液装入酸式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)E中在锥形瓶下垫一张白纸的作用是__________________。
(4)D步骤中尖嘴部有气泡,滴定后气泡消失,则所测纯度_______(填“偏高”、“偏低”或“不变”) 。
(5)滴定终点时锥形瓶内溶液的pH约为_________,终点时颜色变化是_____________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________________(用V1 、V2 、W和c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是

A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径由大到小的顺序为______(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____________________。
(4)②单质与③的最高价氧化物的水化物的浓溶液在加热的条件下反应的化学方程式为__________________________________________。
(5)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最价氧化物反应的化学方程式为___________________________。
(6)⑨的非金属性比⑧的非金属性______(填“强”或“弱”)。符合上述事实是依据有____(选择a-f序号填空)。
a. ⑧的单质的沸点比⑨的单质沸点高
b. ⑨的氢化物比⑧的氢化物稳定
c. ⑨的最外层电子数比⑧的多
d. ⑧的最高价氧化物的水化物的酸性比⑨的最高价氧化物的水化物的酸性弱
e. ⑨的单质能与⑧的氢化物反应生成⑧的单质
f. ⑨的氢化物的酸性比⑧的氢化物的酸性强
(7)化合物甲是元素③形成的最简单氢化物,甲的电子式是_________________。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是______________。
(8)①和③形成的18电子的化合物乙是一种应用广泛的化工原料,写出乙的化学式________。实验室中可用次氯酸钠溶液与氨反应制备乙,反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
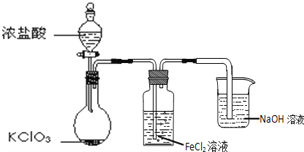
(1)NaOH溶液的作用是______。
(2)实验中,需控制氯气产生的速度,以便使FeCl2溶液转化完全。控制生成氯气速度的操作是______。
(3)开始反应后,在洗气瓶和烧杯所盛放的物质中,被氧化的是______(填化学式)。
(4)烧瓶中发生反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应2FeCl3+Cu=CuCl2+2FeCl2 , 则下列判断正确的是( )
A.该反应是置换反应
B.该反应中FeCl3作还原剂
C.还原性:Cu>Fe2+
D.氧化性:CuCl2>FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com