将5.1g镁铝合金溶于60mL 5mol?L-1的H2SO4溶液中,完全溶解后再加入65mL 10.0mol?L-1 的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少.
(1)当加入 mL NaOH溶液时,可使溶液在硫酸中的Mg和Al恰好完全沉淀.
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积 .
【答案】
分析:所发生的反应为:Mg+H
2SO
4=MgSO
4+H
2↑,2Al+3H
2SO
4=Al
2(SO
4)
3+3H
2↑,MgSO
4+2NaOH=Mg(OH)
2↓+Na
2SO
4,
Al
2(SO
4)
3+6NaOH=2Al(OH)
3↓+3Na
2SO
4,根据反应的方程式计算.
解答:解:所发生的反应为:Mg+H
2SO
4=MgSO
4+H
2↑,2Al+3H
2SO
4=Al
2(SO
4)
3+3H
2↑,MgSO
4+2NaOH=Mg(OH)
2↓+Na
2SO
4,
Al
2(SO
4)
3+6NaOH=2Al(OH)
3↓+3Na
2SO
4,
(1)n(H
2SO
4)=0.06L×5mol/L=0.3mol,当硫酸中的Mg和Al恰好完全沉淀时,溶液成分为Na
2SO
4,
此时n(NaOH)=2n(H
2SO
4)=2×0.3mol=0.6mol,
所以V(NaOH)=
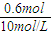
=0.06L=60ml,
故答案为:60;
(2)当加入60mlNaOH溶液时,镁铝恰好沉淀,当加入n(NaOH)=0.065L×10mol/L=0.65mol时,
NaOH过量:0.65mol-0.6mol=0.05mol,发生:Al(OH)
3+NaOH=NaAlO
2+2H
2O,
则溶解的n(Al(OH)
3)=0.05mol,m(Al(OH)
3)=0.05mol×78g/mol=3.9g,
所以硫酸中的Mg和Al恰好完全沉淀的质量应为3.9g+9.7g=13.6g,
设混合物中含有xmolMg,ymolAl,则
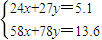
,解之得:x=0.1,y=0.1,
Mg+H
2SO
4=MgSO
4+H
2↑
0.1mol 0.1mol
2Al+3H
2SO
4=Al
2(SO
4)
3+3H
2↑
0.1mol 0.15mol
n(H
2)=0.1mol+0.15mol=0.25mol,
V(H
2)=0.25mol×22.4L/mol=5.6L,
故答案为:5.6L.
点评:本题考查混合物的计算,题目难度中等,注意判断加入65mL10.0mol?L
-1的NaOH溶液反应的程度为解答该题的关键.

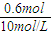 =0.06L=60ml,
=0.06L=60ml,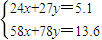 ,解之得:x=0.1,y=0.1,
,解之得:x=0.1,y=0.1,

 名校课堂系列答案
名校课堂系列答案