

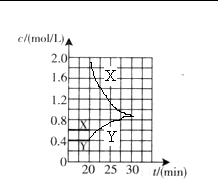
| △ c |
| △ t |
| 0.4mol/L |
| 0.2mol/L |
| 总质量 |
| 体积 |
| 总质量 |
| 总物质的量 |
| c2(NO2) |
| c(N2O4) |
| 0.6×0.6 |
| 0.4 |
| c2(NO2) |
| c(N2O4) |
| 0.9×0.9 |
| c(N2O4) |
 .
.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、对“地沟油”进行分馏可得到汽油 |
| B、向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C、PM2.5、二氧化碳都属于空气质量日报的内容 |
| D、误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.58 | 5.16 | 6.45 |
| 产生CO2的体积(mL)(标准状况) | 672 | 1344 | 1344 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B、放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C、放电时,当有2mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D、充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B、用NaOH溶液滴定HY,当V(NaOH)=10mL时溶液中c(Y-)>c(Na+)>c(H+)>c(OH-) |
| C、用NaOH溶液滴定HY,当V(NaOH)=10mL时溶液中c(Na+)=c(Y-)+c(HY) |
| D、当三种酸均滴定至pH=7时,HZ所用NaOH溶液体积最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com