���쳣�Ӱ����ֳ���������ζ����ȡ����������������ζ�ijɷ��к������»���������������ۻ�ʮ��������5��9ʮһ������������ʮ���飻��ȩ���߸�ȩ������˵����ȷ����
- A.
�١��ڡ��ۡ�������̼ԭ����С��10���ܡ��ݷ�����̼ԭ��������10
- B.
�١���������ۡ��ݡ������л���
- C.
�١��������Ի�����ۡ��ݲ������Ի�����
- D.
�ڡ��ۡ��ܺ���Ԫ�أ��ݡ��ޡ��߲�����Ԫ��
C
������A���������ʵ����ƺͺ���̼ԭ�ӵ���Ŀ֪ʶ���ش�
B�����������̼Ԫ�صĻ����������л��
C���ܺ�ǿ�Ӧ�����κ�ˮ���������������������
D���������ʵ����Ԫ�����ش�
���A���ۻ�ʮ������̼ԭ������10����A����
B�������������ۻ�ʮ��������5��9ʮһ������������ʮ���飻��ȩ���߸�ȩ�������л����B����
C������������������л����ᣬ�������Ի�����ۢ�Ҳ�������Ի������C��ȷ��
D�����ᡢȩ����������������Ԫ�أ��ʢڡ��ۡ��ܡ��ߡ�����Ԫ�أ�����ֻ��C��HԪ�أ���D����
��ѡC��
���������⿼��ѧ�����ʵķ���֪ʶ�����Ը�����ѧ֪ʶ���лش��ѶȲ���
��ϰ��ϵ�д�
���ϰ��
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
2g������ȫȼ������Һ̬ˮʱ�ɷų�285.8KJ�������������Ȼ�ѧ����ʽ��ȷ����
- A.
2H2(g)+O2(g)==2H2O(g) ��H=-571.6kJ/mol
- B.
2H2(g)+O2(g)==2H2O(l) ��H=-285.8kJ/mol
- C.
H2+1/2 O2==H2O ��H=-285.8kJ/mol
- D.
2H2(g)+O2(g)==2H2O(l) ��H=-571.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
����֪��2H2��g��+O2��g��=2H2O��l�����SH=-572kJ/mol��H��H���ļ���Ϊ436kJ/mol��O��O���ļ���Ϊ498kJ/mol����H2O������O��H���ļ���Ϊ
- A.
485.5 kJ/mol
- B.
610 kJ/mol
- C.
917 kJ/mol
- D.
1220 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
��֪���Ż������ͭ��Һ��̼������Һ����Ҫ��Ӧ��Cu2++CO32-+H2O��Cu��OH��2��+CO2����Ҫ��Ӧ��Cu2++CO32-��CuCO3���ƻ������ͭ��Һ��������Һ����Ҫ��Ӧ��Cu2++S2-��CuS����Ҫ��Ӧ��Cu2++S2-+2H2O��Cu��OH��2��+H2S��
�ɴ˿ɵ����¼��������ܽ�ȴ�С��ϵ��ȷ����
- A.
Cu��OH��2��CuCO3��CuS
- B.
Cu��OH��2��CuCO3��CuS
- C.
CuS ��Cu��OH��2��CuCO3
- D.
CuS ��Cu��OH��2��CuCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
�谢���ӵ³���ΪNA��������˵������ȷ����
- A.
�����£�2.7g��������������������Һ��Ӧʧȥ�ĵ�����Ϊ0.3NA
- B.
100mL1mol?L-1Na2SO4��Һ�к�SO42-����Ϊ0.1NA
- C.
1.7gNH3�к�������ΪNA
- D.
11.2LCO2��8.5gNH3�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ������
483g Na2SO4?10H2O��������Na2SO4?10H2O�����ʵ�����________��Na2SO4?10H2O��Ħ��������________����SO42-�����ʵ�����________������Na+�����ʵ�����________ ����H2O���ӵ���Ŀ��________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
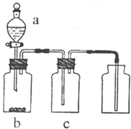 ��ͼװ����ȡ���ᴿ���ռ����е��������壨a��b��c��ʾ��Ӧ�����м�����Լ��������п��е���
��ͼװ����ȡ���ᴿ���ռ����е��������壨a��b��c��ʾ��Ӧ�����м�����Լ��������п��е���
| ���� | a | b | C |
| A | NO2 | Ũ���� | ͭƬ | NaOH��Һ |
| B | SO2 | Ũ���� | ͭƬ | ����KMnO4��Һ |
| C | NH3 | Ũ��ˮ | ��ʯ�� | Ũ���� |
| D | CO2 | ϡ���� | Na2CO3���� | Ũ���� |
- A.
A
- B.
B
- C.
C
- D.
D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ������
��1����ˮ�� ���ռ� �۴���ʯ ���Ȼ��ƾ��� ������ �ް��� ������ ������ ��Һ̬�Ȼ��� ��������Һ�����������ܵ������______�����ڵ���ʵ���______�����ڷǵ���ʵ���______��
��2����Ҫ��д�����з���ʽ��
�ٴ������ĵ��뷽��ʽ��______
��С�մ�����θ���������ӷ���ʽ��______
����NaHSO4��Һ�м����п�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
��һ�ܱ�������ʢ��a L Cl2��H2�Ļ�����壬�õ����ȼ�ָ���ԭ��״̬������������Ϊa L����������NaOH��Һ����ȼ�պ�����壬���������ʣ�࣮��������������֪ԭ���������Cl2��H2���ʵ���֮��һ����
- A.
Cl2��H2=1
- B.
Cl2��H2��1
- C.
Cl2��H2��1
- D.
Cl2��H2��1
�鿴�𰸺ͽ���>>




 ��ͼװ����ȡ���ᴿ���ռ����е��������壨a��b��c��ʾ��Ӧ�����м�����Լ��������п��е���
��ͼװ����ȡ���ᴿ���ռ����е��������壨a��b��c��ʾ��Ӧ�����м�����Լ��������п��е���