
| A. | Al | B. | Si | C. | Fe | D. | O |
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡 | |
| D. | 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
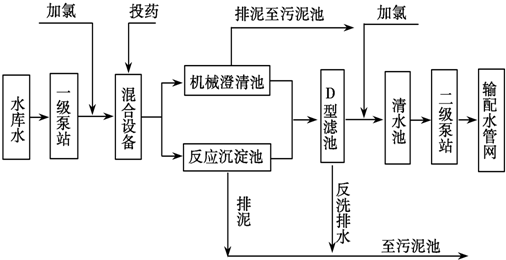
| A. | 若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 | |
| B. | 投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 | |
| C. | 自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 | |
| D. | 用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ③⑤⑥⑦ | C. | ④⑤⑥ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com