
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 吸热反应不加热不可能进行反应 | |
| D. | 反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的 |
分析 A..需要加热才能进行的化学反应不一定是吸热反应;
B.放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生;
C.吸热反应常温下也可以发生反应;
D.反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的,若反应物总能量大于生成物总能量为放热反应,反应物总能量小于生成物总能量为吸热反应.
解答 解:A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,故A错误;
B.放热反应在常温下不一定很容易发生,如碳与氧气的反应为放热反应,但须点燃,故B错误;
C.有些吸热反应在常温下可自发进行,如氯化铵和氢氧化钡的反应,故C错误;
D.反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的,若反应物总能量大于生成物总能量为放热反应,反应物总能量小于生成物总能量为吸热反应,故D正确;
故选D.
点评 本题考查了反应热类型的判断,要注意反应热与反应条件无关,和反应物和生成物的总能量有关,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
 ;KCl第电子式
;KCl第电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: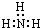 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定不含有FeCl2,含有少量AlCl3 | |
| C. | 混合物中含有0.05molMgCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
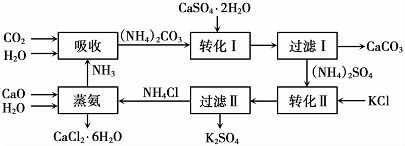
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com