
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 标况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
分析 A、求出双氧水的物质的量,然后根据1mol双氧水中含3mol共用电子对来分析;
B、溶液体积不明确;
C、氯气和水的反应为可逆反应;
D、求出混合气体的物质的量,然后根据甲烷和乙烯中均含4个氢原子来分析.
解答 解:A、3.4g双氧水的物质的量为n=$\frac{3.4g}{34g/mol}$=0.1mol,而1mol双氧水中含3mol共用电子对,故0.1mol双氧水中含0.3NA对共用电子对,故A错误;
B、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故B错误;
C、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故C错误;
D、标况下11.2L混合气体的物质的量为0.5mol,而甲烷和乙烯中均含4个氢原子,故0.5mol混合物中含2NA个氢原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
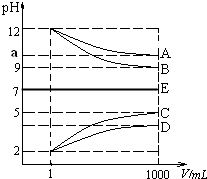 物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:
物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

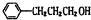 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;该反应的反应类型为酯化反应或取代反应
+H2O;该反应的反应类型为酯化反应或取代反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| F | Cl | Br | I | |
| 第一电离能((kJ•mol-1)) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
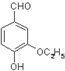 是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称醛基、羟基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称醛基、羟基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.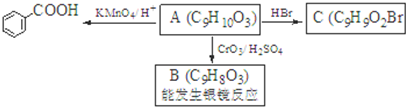
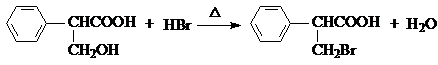 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛(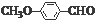 )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com